(Cucurbituril, CB6, CB[6])
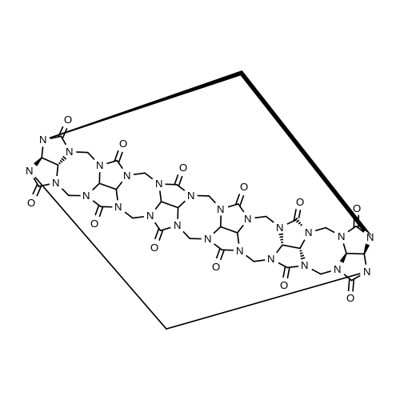
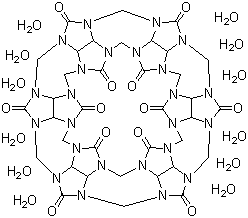
Cucurbit[6]uril (CB[6]) ist ein makrocyclisches Molekül, das aus 6 Glycoluril-Einheiten aufgebaut ist, die über 12 Methylenbrücken an den Stickstoffatomen miteinander verknüpft sind und - wie auch Cyclodextrine oder Calix[n]arene - über einen Hohlraum verfügt, in dem andere Moleküle aufgenommen werden können. Dabei leitet sich der Name aufgrund der kürbisähnlichen Gestalt vom lateinischen Namen des Kürbis (Cucurbita pepo) ab. Die Darstellung gelang erstmals 1905, wobei die Struktur bis 1981 ungeklärt blieb. CB[6] ist der einfachste Vertreter der Cucurbit[n]urile, dessen Bildung unter den üblichen Reaktionsbedingungen oft bevorzugt ist. Mittlerweile wurden auch kleinere und größere Cucurbiturile isoliert, was jedoch oft sehr aufwändig und verlustreich ist. Daher ist das mit moderaten bis guten Ausbeuten darstellbare CB[6] der gebräuchlichste Vertreter, wobei oft die Anzahl der Glycoluril-Einheit im Namen weggelassen und es nur als Cucurbituril bezeichnet wird.

Geräte:
Erlenmeyerkolben, Glaskolben, Heizquelle, Magnetheizrührer mit Ölbad, Möglichkeit zur Vakuumfiltration, Messzylinder, Waage
Chemikalien:
Glyoxal-Lösung 40 %

Salzsäure
Harnstoff
Paraformaldehyd

Glycoluril

Cucurbituril

Hinweis: Die zweite Stufe sollte in einem versiegelten Vial oder Schlenkrohr, im Freien oder unter einem gut ziehenden Abzug durchgeführt werden, da bei Reaktionen von Salzsäure und Formaldehyd carcinogene Nebenprodukte (Bis(2-chlormethyl)ether) entstehen können.
Durchführung:
Glycoluril:
20 g Glyoxal-Lösung 40% und 3,5 mL konzentrierte Salzsäure werden mit 40 mL destilliertem Wasser in einem Erlenmeyerkolben vorgelegt und 24 g Harnstoff hinzugegeben. Die Mischung wird unter Rühren zum Sieden erhitzt, wobei sich ein farbloser Niederschlag bildet. Längeres Erhitzen bewirkt eine Steigerung der Ausbeute, verfärbt jedoch den Niederschlag leicht bräunlich. Der Niederschlag wird nach dem Abkühlen auf Raumtemperatur filtriert, mit Wasser gewaschen und anschließend im Trockenschrank bei 140 °C bis zur Massekonstanz getrocknet.
Ausbeute: 17,26 g (88,1 % d.Th.)
Cucurbituril:
1,7 g Glycoluril und 930 mg Paraformaldehyd werden in 5 mL konzentrierter Salzsäure unter Rühren für 24 Stunden auf 95 °C erhitzt. Dabei geliert die Suspension nach wenigen Minuten, klärt sich aber beim Erreichen der Reaktionstemperatur wieder auf und wird gut rührbar. Die Lösung wird anschließend bei 5 °C für mehrere Tage stehen gelassen, wobei sich große, glasklare Kristalle bilden. Neben den Kristallen findet sich ein feiner Niederschlag in der Lösung, der durch Aufschlämmen und dekantieren entfernt wird. Die Kristalle werden danach mehrfach mit konzentrierter Salzsäure gewaschen und auf einem Filterpapier bei 30 °C getrocknet. CB[6] kristallisiert als Polyhydrat-polyhydrochlorid und gibt das Wasser und den Chlorwasserstoff beim Trocknen teilweise ab, weshalb die anfangs klaren Kristalle trüb werden und bei stärkerem Trocknen zu einem weißen Pulver zerfallen.
Ausbeute: 429 mg (Ausbeute nicht bestimmt, da genaue Zusammensetzung nicht bekannt.)
Entsorgung:
Die sauren Abwässer werden alkalisiert und kurz aufgekocht (Hydrolyse eventuell entstandenen Bis(2-chlormethyl)ethers), neutralisiert und dem Abwasser zugeführt. Das Produkt wird aufgehoben oder dem halogenfreien organischen Abfall zugeführt.
Erklärung:
Im ersten Schritt wird Glyoxal mit zwei Molekülen Harnstoff zum Glycoluril umgesetzt, aus dem durch Reaktion mit Formaldehyd/Paraformaldehyd im Sauren CB[6] gebildet wird.

Bilder:

Lösung aller Edukte zur Glycoluril-Synthese

Ausfallendes Glycoluril

Gelierte Lösung der CB[6]-Synthese

Nach wenigen Stunden Reaktionszeit

Nach 24 Stunden Erhitzen ist die Lösung trüb

Beim Abkühlen nach mehreren Tagen bilden sich große Kristalle des Produktes

Produktkristalle

Produkt nach wenigen Minuten Trocknen bei 30 °C
Meinen Dank an Xyrofl für die Hilfe beim Erstellen der anschaulichen Strukturformel des CB[6].