Stilbazoliumsalze leiten sich vom Stilben ab, wobei eines der C-Atome innerhalb der Aromaten durch ein Stickstoffatom ersetzt wurde und dieses unter Erhalt der Aromatizität eine positive Ladung trägt. Wenn der nicht-stickstoffsubstituierten Ring ein Phenolat ist ergeben sich daraus sog. Merocyanine, die eine besondere Form der Cyanin-Farbstoffe darstellen. Dabei wäre es sinnvoll zuvor ein wenig auf Cyanin-Farbstoffe einzugehen um die Unterschiede deutlich zu machen. Cyanine gehören zu den Polymethinfarbstoffen welche konjugierte Polyene sind, in denen ein Elektronenakzeptor X über eine ungeradezahlige Kette von Methingruppen mit einem Elektronendonator Y verknüpft ist, durch Mesomerie können X und Y ihre Rolle als Akzeptor bzw. Donator tauschen:
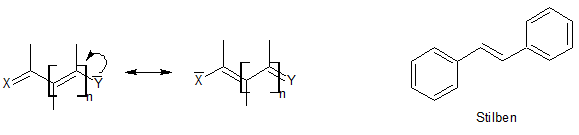
Die folgende Übersicht über die Polymethinfarbstoffe zeigt, dass es positiv (Hemi- und Streptocyanine, falls Y oder X Teil eines Heterocyclus ist liegt ein Hemicyanin vor und bei offenkettigen Cyaninen spricht man von Streptocyaninen), neutral (Neutro- oder Merocyanine) und negativ (bei Vinylogen des Coarboxylat-Ions spricht man von Oxonolen) geladene Cyanine gibt. Dabei kann an die Stelle einer C-C-Doppelbindung auch eine C-N-Doppelbindung treten, wobei man dann von Azacyaninen spricht.
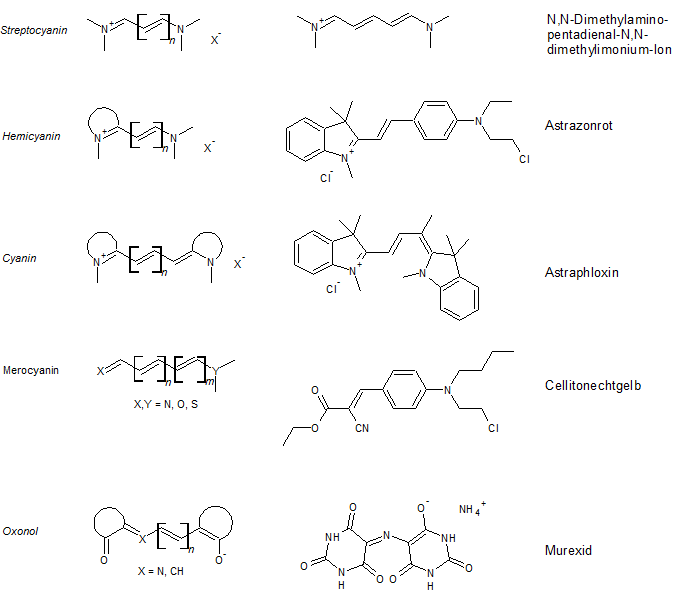
Häufig verwendete Bausteine sind dabei die Ionen von N-Alkyl-2-methylchinolin, 4-Methylchinolin, 2-Methylbenzothiazol und N-Alkyl-2,3,3-trimethylindol, welche sich in den typischen Polymethinfarbstoffen wiederfinden.
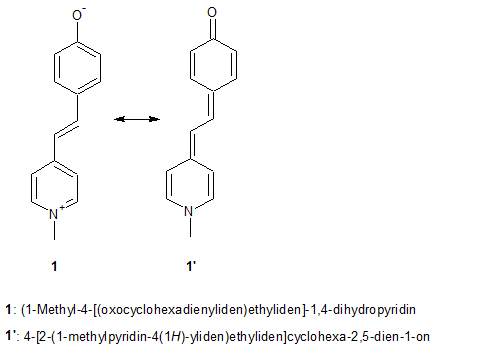
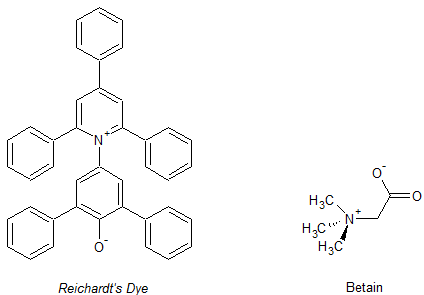
Das Hauptaugenmerkt dieser Arbeit liegt dabei auf den Merocyaninen, welche sich durch eine gut sichtbares Solvatochromie und einfache Synthese auszeichnen. Der bekannteste Vertreter ist dabei das Brooker's Merocyanin(e), wobei es sich dabei um das (1-Methyl-4-[(oxocyclohexadienyliden)ethyliden]-1,4-dihydropyridin, kurz MOED genannt, handelt. Wie es für Merocyanine typisch ist, können sie durch Mesomerie sowohl in ionischer 1 (dennoch neutrales Molekül) oder nicht-ionischer Form 1' vorliegen. Wichtig ist, dass die Merocyanine nur in ihrer ionischen Struktur einem Stilbazoliumsalz entsprechen. Durch diese Eigenschaft ist es möglich für das Molekül zwei verschiedene Namen nach IUPAC-Nomenklatur zu entwickeln, welche jedoch das selbe Molekül meinen. Diese Eigenschaft ist die Ursache der Solvatochromie, wobei in Lösungsmitteln mit unterschiedlicher Polarität jeweils die ionische oder nicht-ionische Struktur stabilisiert wird, was unterschiedliche Färbungen der Lösungen mit sich bringt.
Während sich bei den Merocyaninen die Solvatochromie mit der durch die Polarität des Lösungsmittel induzierten Beeinflussung der Mesomerie erklären lässt scheitert dieser Erklärungsansatz bei den sog. Betain-Farbstoffen. Sie sind durch ihre Struktur so gebaut, dass nur eine ionische Form möglich und eine nicht-ionische Form unterbunden ist.
Das bekannteste Beispiel dafür ist der sog. Reichardt's Dye, welcher mittlerweile auch als Standard zur Bestimmung der Lösungsmittelpolarität herangezogen wird.
So wurden im Rahmen dieser Arbeit folgende Verbindungen synthetisiert:
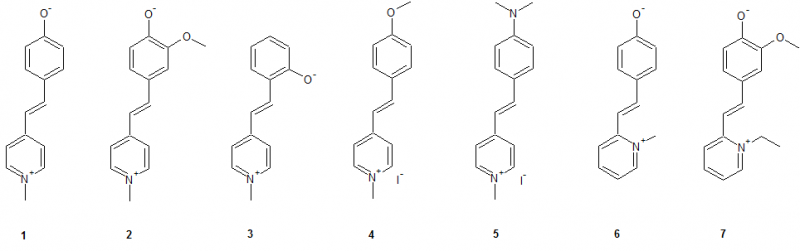
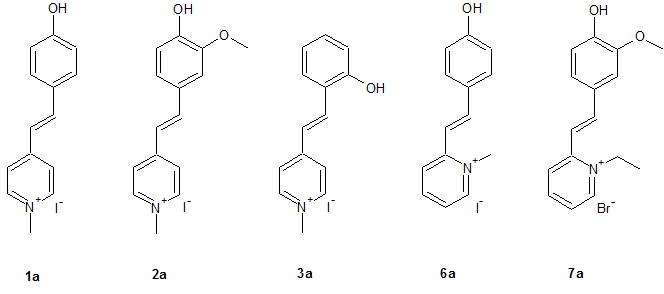
Dabei wurde das MOED als Grundstruktur angenommen und durch gezielte Veränderungen im Molekül die Veränderungen der Eigenschaften untersucht. Wie man sieht entsprechen nicht alle Strukturen die Kriterien eines Merocyanins, jedoch können als als Stilbazoliumsalz betrachtet werden, wobei alle Strukturen - mit Ausnahme von 4 und 5 - intramolekulare Stilbazoliumsalze darstellen.
Die allgemein Synthese dieser Farbstoffe erfolgt in drei Stufen, wobei zuerst das N-Alkylpicoliniumiodid 8 mit einem Hydroxybenzaldehyd umgesetzte und zuletzt mit Kaliumhydroxid dehydrohalogeniert wird.
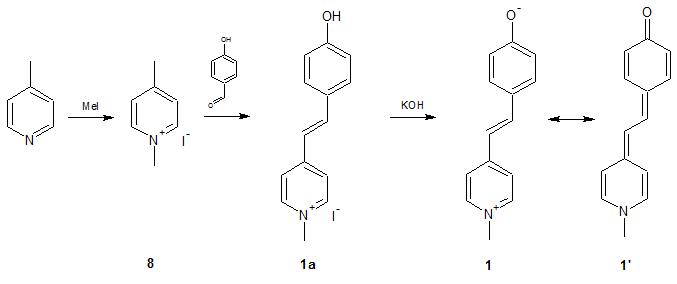
Beispielroute für MOED
Es sind viele weitere Substitutionen möglich, wobei zu beachten ist, dass die Hydroxygruppe und der Stickstoff jeweils stets in ortho- oder para-Stellung sein müssen. Eine Substitution in meta-Position ermöglicht nicht die für die Solvatochromie notwendige Mesomerie.
Eine besondere Rolle nimmt Lemmi's dye 7 ein, dieser wurde speziell konzipiert um mit möglichst ungiftigen Chemikalien ein Merocyanin mit ähnlicher Solvatochromie herzustellen.
Geräte:
100 mL Rundkolben, 250 mL Rundkolben, Refluxanlage, Magnetheizrührer mit Ölbad, Möglichkeit zur Vakuumfiltration, diverse Bechergläser, Exsikkator
Chemikalien:
4-Picolin

2-Picolin

Methyliodid

Ethylbromid


2-Propanol


Piperidin


Ethanol ketonfrei

Kaliumhydroxid
4-Hydroxybenzaldehyd

Vanillin
Salicylaldehyd

Anisaldehyd

p-N,N-Dimethylaminobenzaldehyd

Methanol
Hinweis: Die toxischen Eigenschaften der Produkte sind ungeklärt, weshalb sie mit entsprechender Vorsicht zu handhaben sind.
Durchführung:
Für die jeweiligen Verbindungen werden folgende Edukte benötigt:
1: 4-Picolin, Methyliodid, 4-Hydroxybenzaldehyd
2: 4-Picolin, Methyliodid, Vanillin
3: 4-Picolin, Methyliodid, Salicylaldehyd
4: 4-Picolin, Methyliodid, Anisaldehyd
5: 4-Picolin, Methyliodid, p-N,N-Dimethylaminobenzaldehyd
6: 2-Picolin, Methyliodid, 4-Hydroxybenzaldehyd
7: 2-Picolin, Ethylbromid, Vanillin
Allgemein Arbeitsvorschriften:
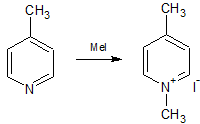
N-Alkylpicoliniumhalogenide:
0,1 mol des entsprechenden Picolins werden mit 0,11 mol Alkyliodid (Alkylbromid) in 20 mL 2-Propanol 3 h refluxiert. Nach dem Abkühlen wird es mit wenig 2-Propanol in ein Becherglas überführt und im Kühlschrank abgekühlt. Anschließend wird der Niederschlag filtriert und mit 30-40 mL eiskaltem 2-Propanol gewaschen und anschließend im Vakuum getrocknet.
1,4-Dimethylpyridiniumiodid: 95,2 % feine weiße Kristalle
1,2-Dimethylpyridiniumiodid: 89,4 % leicht beiges Pulver
1-Ethyl-2-methylpyridiniumbromid: nicht bestimmt da nicht isolierbar, Lösung direkt weiterverwendet
(1,2,4-Trimethylpyridiniumiodid: 87,9 % leicht beiges kristallines Pulver)
Stilbazoliumsalze:
21,3 mmol des entsprechenden N-Alkylpicoliniumiodide werden mit 21,3 mmol des entsprechenden Aldehyds in 26 mL ketonfreiem Ethanol vorgelegt und 2,13 mmol Piperidin hinzugetropft. Die Mischung wird für 2 h refluxiert und 1h im Gefrierschrank abgekühlt. Der Feststoff wird abgesaugt und mit ein wenig eiskaltem Ethanol (hierbei ist kein ketonfreies Ethanol notwendig) gewaschen, dann aus 20-30 mL Methanol umkristallisiert und anschließend im Vakuum getrocknet.
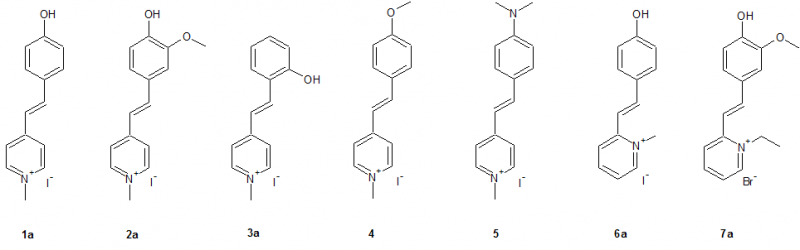
1a: 4-[2-(4-hydroxyphenyl)ethenyl]-1-methylpyridiniumiodid: 82,1 % rote Kristalle
2a: 4-[2-(4-hydroxy-3-methoxyphenyl)ethenyl]-1-methylpyridiniumiodid: 95,0 % beige Kristalle
3a: 4-[2-(2-hydroxyphenyl)ethenyl]-1-methylpyridiniumiodid: nicht bestimmt, da nicht isolierbar (nur Ethanol abgezogen)
4: 4-[2-(4-methoxyphenyl)ethenyl]-1-methylpyridiniumiodid: 54 % orangegoldene Kristalle
5: 4-{2-[4-(dimethylamino)phenyl]ethenyl}-1-methylpyridiniumiodid: 83,0 % dunkelrote Nadeln
6a: 2-[2-(4-hydroxyphenyl)ethenyl]-1-methylpyridiniumiodid 87,3 % oranges Pulver
7a: 1-ethyl-2-[2-(4-hydroxy-3-methoxyphenyl)ethenyl]pyridiniumbromid: 89,5 % gelborange Kristalle
Dehydrohalogenierung:
13,55 mmol des entsprechenden Stibazoliumiodides wird mit 17,47 mmol Kaliumhydroxid in 100 mL destilliertem Wasser für 1,5 h bei 65 °C gehalten. Nach dem Abkühlen wird der Niederschlag abgesaugt und aus 50 mL destilliertem Wasser umkristallisiert. Nach dem Abfiltieren wird zuerst im Vakuum vorgetrocknet und anschließend über Nacht im Exikkator im Vakuum über P2O5 getrocknet.
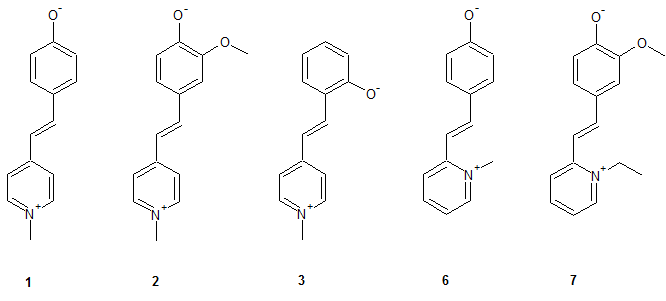
1: 4-[2-(1-methylpyridinium-4-yl)ethenyl]phenolat: 92 % rote glänzende Schuppen
2: 2-methoxy-4-[2-(1-methylpyridinium-4-yl)ethenyl]phenolat: 97 % grünes amorphes Pulver mit metallischem Glanz
3: 2-[2-(1-methylpyridinium-4-yl)ethenyl]phenolat: 82 % rote Nadeln mit metallischgrünem Glanz
4: 4-[2-(1-methylpyridinium-2-yl)ethenyl]phenolat: 85 % matte rote Schuppen
7: 4-[2-(1-ethylpyridinium-2-yl)ethenyl]-2-methoxyphenolat: nicht bestimmt
Entsorgung:
Die Lösungsmittel werden dem organischen Lösungsmittelabfall zugeführt und die Feststoffe aufbewahrt.
Erklärung:
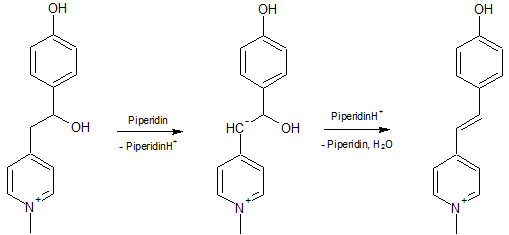
Im ersten Schritt wird das Picolin alkyliert und es bildet sich das N-Alkylpicoliniumhalogenid. (Alkyliodide ergeben die besten Ergebnisse, das N-Ethylpicoliniumbromid ist nur schwer isolierbar, weshalb die Lösung direkt weiter verwendet wurde.)
Im zweiten Schritt wird das N-Alkylpicoliniumion (Iodidion nicht berückstichtigt) durch das Piperidin deprotoniert und greift nach Mesomerie an das Carbonyl-C-Atom des Aldehydes unter Bildung des entsprechenden Alkoholates an, welches unter Rückbildung des Katalysators zum Alkohol reagiert.
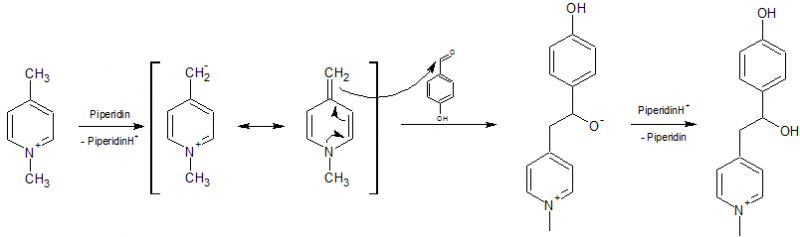
Es folgt die basenkatalysierte Dehydratisierung zum Olefin.
Im letzten Schritt wird das Stilbazoliumsalz durch Kaliumhydroxid dehydrohalogeniert wobei sich das freie Merocyanin bildet.
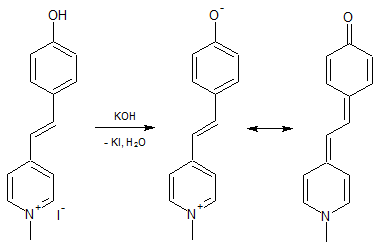
Während es beim Stilben sowohl das trans- als auch das cis-Isomer gibt, existieren bei den Merocyaninen keine isolierbaren trans-cis-Isomere, da durch die Mesomerie in die nicht-ionische Form ein permanenter Wechsel der trans-cis-Isomere durch Rotaion um die C-C-Einfachbindung erfolgt.
Es fällt auf, dass die Produkte in einer unterschiedlichen Form anfallen: Während die Merocyanine mit mehr als einem Substituenten an jedem Ring (2 und 7) nach meinen Erkenntnissen wasserfrei nicht kristallisieren sondern amorphe Pulver bilden, kristallisieren die Merocyanine mit jeweils nur einem Substituenten an jedem Ring (1, 3, 4, 5 und 6) gut bis sehr gut. Dabei fällt auf, dass gerade die Verbindungen welche amorph anfallen einen ausgeprägten Drang zu Hydratbildung haben, bei denen sich die verschiedenen Hydrate unterschiedliche färben. Genaue Angaben über die Anzahl der Hydrate konnte nicht ermittel werden, aber bei 2 besteht der Verdacht, dass 2-3 Hydratstufen existieren, wobei die mit der geringsten dunkelviolett ist und höhere Hydrate rot bis gelb gefärbt sind. Die wasserfreie Verbindung bildet hingegen ein fast schwarzes amorphes Pulver mit metallisch grünem Glanz, gleiches gilt für 7, wobei nur ein Hydrat in Form eines rotebraunem amorphen Pulvers gefunden wurde. Für beide Verbindungen gilt, dass es sie aus Wasser gut kristallisieren und eindeutig Kristalle bilden, welche beim Trocknen unter Farbveränderung zu einem schwarzen Pulver zerfallen. In der Literatur sind auch Merocyanine mit tBu-, n-Octyl und anderen Substituenten bekannt, auf die die Bildung amorpher Pulver mit metallischen Glanz ebenfalls zutrifft. 2, 3 und 7 sind daher hygroskopisch und verlieren bereits nach wenigen Minuten an der Luft ihren metallischen Glanz und bilden die rot gefärbten Hydrate. Der Grund für die Farbvertiefung bei den wasserfreien Substanzen liegt darin, dass sich bei den Hydraten polare Wassermoleküle im Kristallgitter befinden, die die ionische Struktur der Merocyanine stabilisieren. Die hier synthetisierten Verbindungen verfügen in der ionischen Form über zwei aromatische Ringe, die über eine Ethylen-Brücke verknüpft sind. Durch die Aromatizität ist die Färbung der Verbindung nicht so intensiv wie in der nicht-ionischen Form, in der sich durchkonjugierte Systeme bilden, die durch ihre Vielzahl an beweglichen Elektronenpaaren sehr dunkel/fast schwarz sind und einen metallischen Glanz aufweisen.
Zur Untersuchung der Solvatochromie wurde alle Verbindungen in den selben Lösungsmitteln gelöst und fotografiert. Darüber hinaus wurden die Proben auch unter UV-Licht betrachtet, wobei gut zu erkennen ist, dass in einigen Lösungsmitteln eine Fluoreszenz erkennbar ist. Da die Färbung sowohl stark konzentrations- als auch temperaturabhängig ist, kann es sein, das sich die fotografierten Farben nicht exakt reproduzieren lassen, wobei natürlich die Abweichung durch die Fotografie hinzukommt. Dennoch gibt die Abbildung einen Überblick über die möglichen Farben in einigen Lösungsmittel. Darüber hinaus sind auch Lösungsmittelgemische möglich, womit sich nahezu die ganze Farbpalette abdecken lässt.

Verwendete Lösungsmittel: Ethanol, N-Methylpyrrolidon, Methanol, Wasser, N,N-Dimethylformamid, Pyridin, Aceton, Acetonitril, Tetrahydrofuran, 2-Propanol
Um nachzuweisen, dass die mögliche Mesomerie der Merocyanine für deren Solvatochromie verantwortlich ist wurde bei 4 der Donator (das Phenolat-Ion) durch eine Methylgruppe blockiert. Dies ist zum einen durch die Reaktion von MOED mit Methyliodid möglich oder es kann gleich Anisaldehyd anstatt 4-Hydroxybenzaldehyxd eingesetzt werden. Durch diese Blockierung ist in den gängigen Lösungsmitteln mit dem Auge keine Solvatochromie mehr feststellbar. Dafür besitzt die Verbindung eine ausgeprägte grüne Fluoreszenz. Dazu wurden gleiche Mengen 4 in Methanol und Ethanol gelöst, die bereits unterschiedliche Polaritäten haben. In den anderen oben verwendeten Lösungsmitteln fällt das Ergebnis - vorausgesetzt der Stoff löst sich - ähnlich aus.

Verbindung 5 ist dahingehend interessant, dass es trotz Vorhandensein eines Donators keine Solvatochromie aufweist, dafür aber eine kräftige orange Fluoreszenz. Der Grund ist vermutlich, dass die Polarität des Lösungsmittels nicht ausreicht um die Mesomerie maßgeblich zu beeinflussen. Dazu wurden ebenfalls gleiche Mengen in Methanol und Ethanol gelöst.

Wie es für solvatochrome Verbindungen üblich ist, weisen sie auch eine Thermochromie auf, da die Polarität eines Lösungsmittels temperaturabhängig ist. Darüber hinaus lässt sich auf diese Weise auch die Fluoreszenz beeinflussen. Zwar findet sich hier keine solvatochrome Fluoreszenz in der Form, dass sich die Fluoreszenzfarbe maßgeblich ändert, aber bei höherer Temperatur wird die Fluoreszenz gequencht, so dass sie kaum sichtbar wird. Dazu wurde eine methanolische Lösung von 2 hergestellt und erhitzt und der Abkühlprozess mit Hilfe eines Intervalorometers aufgenommen. Der Effekt ist nur sehr schwach zu sehen, da es schwierig ist ein geeignetes Lösungsmittel mit passender Konzentration zu finden, bei dem sowohl eine Fluoreszenz bei Raumtemperatur als auch eine starke Thermochromie sichtbar wird.
Youtube-Link zum Video der Thermochromie
Darüber hinaus eignen sich die Verbindungen 1, 2, 3, 6 und 7 als pH-Indikatoren wobei im Alkalischen eine dunkelrote und im Sauren eine gelbe Färbung auftritt, dabei gibt es keine sichtbaren Unterschiede zwischen allen Verbindungen
Bilder:

vorgelegtes 4-Picolin in 2-Propanol

Zugabe des Methyliodids

siedendes Reaktionsgemisch

ausgefallenes 1,4-Dimethylpyridiniumiodid

gewaschenes und getrocknetes 1,4-Dimethylpyridiniumiodid

vorgelegtes 1,4-Dimethylpyridiniumiodid und Vanillin in Ethanol zur Synthese von 2a









Reaktionsfortschritt nach Zugabe des Piperidins

ausgefallenes Produkt 2a

2a neben dem 1,4-Dimethylpyridiniumiodid

Dehydrohalogenierung vor Reaktionsbeginn (2a in Kalilauge)

noch warme Lösung

ausgefallenes Produkt 2

abgesaugtes 1a

auskristallisiertes 3

Farbveränderung von 3 beim Trocknen

auskristallisiertes 4

abgesaugtes 7a

abgesaugtes 7

Alle isolierten Zwischenverbindungen 1a, 2a, 6a und 7a

Alle Zielverbindungen 1, 2, 3, 4, 5, 6 und 7

Verbindung 3

Verbindung 4

Verbindung 5