Die Amidresonanz (Amidmesomerie) beschreibt eine bei Carbonsäureamiden, Hydroxypyridinen (tritt auch bei Thiolen und evtl. Selenolen auf) und acht- bis zehngliedrigen N-heterocyclischen Ketonen (evtl. auch S- und Se-heterocyclischen) auftretende mesomere Grenzstruktur der Carbonyl- und der (vicinale) Amidgruppe, bei der sich die Elektronen in Richtung des Sauerstoffes (Schwefels oder Selens [?]) verschieben und das Molekül durch eine sp2-Hybridisierung des Kohlenstoff- und Stickstoffatoms einen partiellen Doppelbindungscharakter aufweißt, der durch z.B. IR-Spektroskopie nachgewiesen werden kann. Dabei ist die C-N-Bindung kürzer als üblich und das freie Elektronenpaar des Stickstoffatoms hat keinen Einfluss mehr auf die Basizität des Moleküls. Diese Grenzstruktur ist meist die bevorzugte und kann durch polare Lösungsmittel (DMF, welches selbst eine Amidresonanz aufweist) stabilisiert werden.
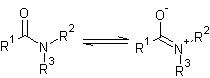
Diese Stabilisierung ist dafür verantwortlich, dass bei der Hydrolyse von (N-substituierten) Carbonsäureamiden starke Basen oder Säuren erforderlich sind. Außerdem schränkt die sp2-Hybridisierung des Kohlenstoffes die freie Rotation von Peptidbindungen ein (Ausbildung einer planaren Ebene) und ermöglicht so eine Gleichgewichtsverlagerung zur trans-Form der Peptide, welche durch die lineare Form leichter Wasserstoffbrückenbindungen ausbilden können.

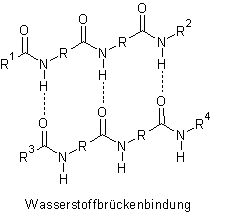
(Peptide stark vereinfacht dargestellt)
Interessanter wird jedoch die Betrachtung anderer stickstoffhaltiger Verbindung, die diese Mesomerie aufweisen.
Ein schönes Beispiel sind die Hydroxypyridine:
2-Hydroxypyridin 1, ein Lactim, kann als (aromatisches) Azaenol
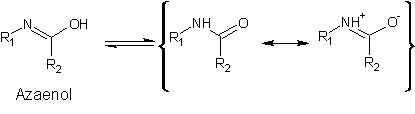
aufgefasst werden und unterliegt deshalb der Amid-Resonanz:
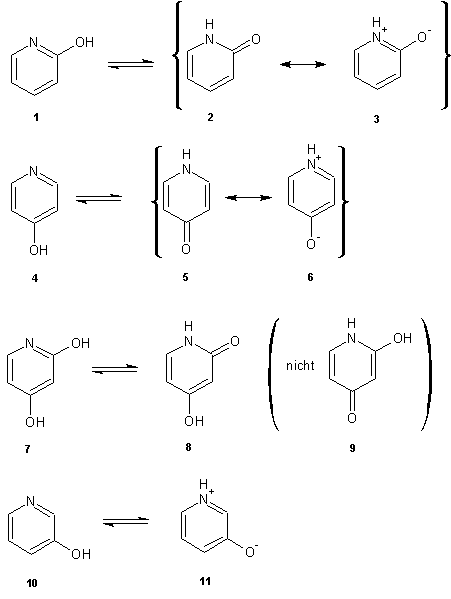
Während bei dem 4-Hydroxypyridin 4 das Gleichgewicht auf der Seite der 4-Oxo-Form 5 (weist Amidresonanz 6 auf) liegt wird beim 2,4-Dihydroxypyridin 7 nur die mesomeriestabilisierte 2-Oxoform 8 gebildet (9 ist nicht nachweisbar). Das ist darauf zurückzuführen, dass durch die Amidresonanz und den daraus resultierenden Doppelbindungscharakter der C-N-Bindung die Aromatizität des Heterocyclus erhalten bleibt. Das 3-Hydoxypyridin 10 bildet keinerlei Oxoformen, da diese keine mesomeriefähigen Amide sind, sondern behält die aromatische Form bei und kann als Zwitterion 11 vorliegen.
Einen Sonderfall bildet die transannulare Amidresonanz, bei der im Gegensatz zu den oben genannten Beispielen KEIN Doppelbindungscharakter (sondern Bildung eines quartären Ammoniumions) zustande kommt und Carbonyl- und Amid-Gruppe auch nicht vicinal liegen müssen/dürfen.
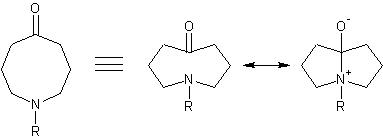
Die transannulare Amidresonanz tritt bei acht- bis zehngliedrigen N-substituierten heterocyclischen Ketonen auf.
Bsp.: N-substituiertes 5-Azocanon (5-Azacyclooctanon)