Dibenzoyl
Benzil kann Edukt für die Synthese von Heterocyclen wie Pyrazinen und Imidazolen, aber auch der pharmazeutisch relevanten Benzilsäure sein. Aus diesem Grund wurden bereits zahlreiche Synthesen publiziert, wobei die Oxidation mit konzentrierter Salpetersäure oder Kupfer(II)-sulfat in Pyridin vertretbare Ausbeuten liefern. Nachteilig ist die Bildung von Stickoxiden im ersten Fall, nach Absorbtion der Gase resultiert, ebenso bei der Kupfersulfat-Route, gesundheitlich wie unter dem Aspekt des umweltschonenden Arbeitens problematischer Abfall. Eine Zusammenführung beider Methoden zu einer effizienten und sicheren Vorschrift soll hier vorgestellt werden.
Geräte:
Magnetheizrührer, Magnetrührfisch, Silikonölbad, Rundkolben, Rückflusskühler, Eisbad, Büchnertrichter, Saugflasche, Vakuumpumpe, Standardequipment
Chemikalien:
Benzoin
Kupfer(II)-sulfat-Pentahydrat


Natriumhydroxid

Essigsäure

Ammoniumnitrat

Ethanol, absolut
Benzil

Hinweis:
Da Essigsäure zu Geruchsbelästigung führen kann, ist das Arbeiten unter dem Abzug fakultativ.
Durchführung:
Herstellung des Katalysators:
Es werden 5 g Kupfer(II)-sulfat-Pentahydrat in etwas Wasser gelöst, eine Lösung von 1,6 g Natriumhydroxid unter Rühren hinzugetropft und der ausfallende Festoff abfiltriert. Die trockengesaugte Masse wird in einem Überschuss an Eisessig resuspendiert und für einige Minuten gerührt, danach erfolgt wiederum Vakuumfiltration des ausfallenden Kupfer(II)-acetat-Monohydrats, welches mit Eisessig gewaschen und an der Luft für 2 Tage stehen gelassen wird.
Oxidation des Benzoins:
In einem 50 ml Rundkolben werden 15 ml Eisessig vorgelegt, in die 4,5 g rekristallisiertes Benzoin, 2,5 g gepulvertes, trockenes Ammoniumnitrat und eine gehäufte Spatelspitze Kupfer(II)-acetat-Monohydrat eingetragen werden. Die Reaktanden gehen nicht in Lösung. Nun wird der Kolben mit einem Rückflusskühler versehen und im Silikonölbad erhitzt. Allmählich lösen sich alle Edukte, wobei die flüssige Phase zunächst eine blaue Farbe zeigt. Ab einer Ölbadtemperatur von 113 °C springt die Reaktion an, was an der Entwicklung eines farblosen Gases (Stickstoff), ohne dass Substanz im Kühler kondensiert, erkennbar ist. Von dort an verändert sich die Färbung der Lösung rasch von blau über türkis nach gelbgrün. Ab 120 °C Badtemperatur setzt Refluxieren ein, was so lange aufrecht erhalten wird, bis keine Gasentwicklung mehr erkennbar ist. Der Ansatz wird abkühlen gelassen. Inzwischen wird ein 100-ml-Becherglas zu der Hälfte seines Volumens mit crushed ice und etwas Wasser beschickt und in ein Eisbad gestellt (nicht zu kalt, andernfalls friert das Glas zu). In dieses wird der auf Raumtemperatur abgekühlte Ansatz samt Rührfisch darinnen gegossen und solange kräftig gerührt, bis keine Klumpen von Rohprodukt mehr übrig sind. Der Niederschlag wird abfiltriert und mit destilliertem Wasser gewaschen. Hernach wird aus absolutem Ethanol umkristallisiert und die Fällung im Eisbad vervollständigt. Die erhaltenen Kristalle trocknen über Nacht.
Ausbeute: 3.62 g (81,2 % d.Th.)
Schmelzpunkt = 95 °C (entspricht)
Benzil bildet farblose bis blassgelbe, nadelförmige Kristalle mit aromatischem Geruch.
Entsorgung:
Die Abfälle können stark verdünnt ins Abwasser gegeben werden.
Erklärung:
Die Reakton verläuft in in zwei Cyclen: Benzoin wird durch Kupfer(II)-Ionen über einen radikalischen Mechanismus zu Benzil oxidiert.
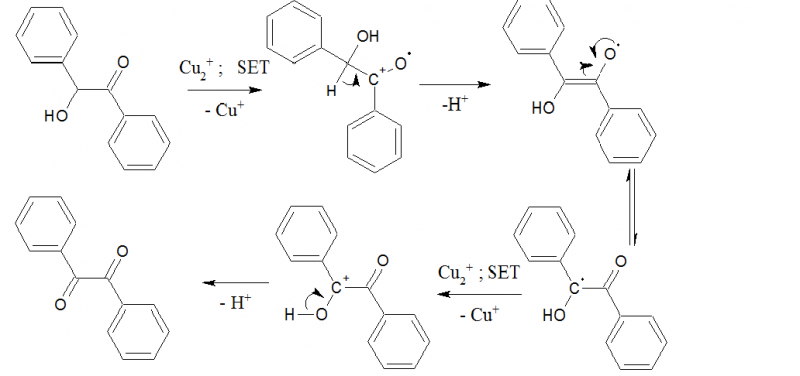
Die Regeneration des Katalysators erfolgt über Oxidation des Cu(I) zu Cu(II) mit Ammoniumnitrat, wobei Stickstoff ausgast und dem System entzogen wird, wodurch die Gleichgewichte auf die gewünschte Seite gedrängt werden. Essigsäure dient als Protonenüberträger und Solvens.
2 Cu+ + NH4NO3 + 2 CH3COOH ---> 2 Cu2+ + N2 + 3 H2O + 2 CH3COO-
Bilder:

Beginnendes Erwärmen, es hat noch keine Farbveränderung stattgefunden.

Die Reaktion springt an

Die konstante, grüne Farbe im fortgeschrittenen Stadium

Aufarbeitung im Eisbad

Während des Umkristallisierens
Quellen:
http://www.sciencemadness.org/talk/file ... &aid=12973