Zusammenfassung: Der Glühdraht einer Halogenlampe wurde in Brennspiritus durch elektrischen Strom zum Glühen erhitzt. Es bildete sich knapp 1 ml/s eines farblosen Gases, dessen Geruch frisch eher "fruchtig" ist und nach Stehen über Wasser Butangas ähnelt.
Geräte: Halogenlampe 20 W 12 V, PC-Netzteil mit 3,3 V 14 A bzw. 5 V 23 A, Voltmeter, 2 Stück Kernschliff 29/32 mit gebogener Schlaucholive, Liebigkühler 40 cm, Vakuumvorstoß gerade, Übergangsstück Hülse 29/32 Kern 14/19, Tropftrichter 500 ml mit Druckausgleich, Schliffklammern, Dreiwegehahn, Eimer 10 l, 4 passende Schläuche, 1 Stopfen mit Loch, 1 kurzes Glasrohr.
Chemikalien:
Leitungswasser
Brennspiritus (Marke Klax von Chemica mit unbekannter Zusammensetzung, CAS-Nr. 64-17-5 für Ethanol, Barcode Nr. 4002832001350)


--------------------->
Gasförmiges Produktgemisch unbekannter Zusammensetzung und Gefährlichkeit!
Vorgehensweise:
An die Kontakte der Halogenlampe (20 W 12 V, Hersteller Müller-Licht, Art.-Nr. 300038, könnte vom DM gewesen sein) habe ich zwei Drähte gelötet. Dann wurde der obere Teil des Quarzkolbens mit einer Abisolierzange abgebrochen (besser wäre wie bei einem früheren Versuch eine große Baumschere). Dazu habe ich die Lampe in einen Gummistopfen gesteckt und mit einem Tuch als Splitterschutz abgedeckt. Der Quarz ist, anders als geplant, vorne bis fast ganz unten abgebrochen, aber stört nicht. Für ein Bild von Lampe vorher und nachher siehe gegen Ende. Hier das Ergebnis:

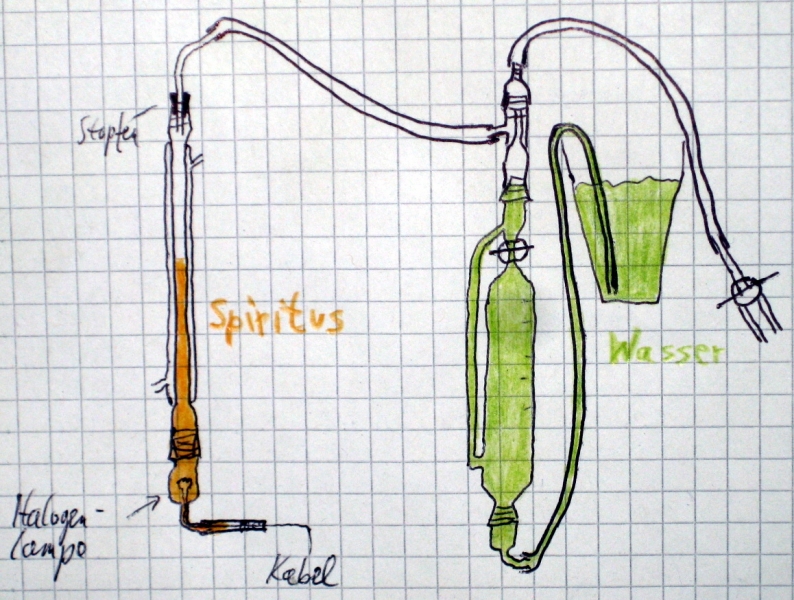
Weiter wurde über eine der Schlaucholiven ein kurzes Stück Schlauch gezogen und dann die Drähte dort durchgezogen, dass die Halogenlampe im Inneren des Schliffs zu liegen kam. Als Dichtung habe ich ein etwa 10 x 29 cm großes Stück Frischhaltefolie (Marke alio, extra stark) mit einem Schraubenzieher so fest wie möglich in den Schlauch gestopft und diese Stelle noch mit einer Schlauchschelle zusammengedrückt.

Zu Beginn wurde erst einmal nur der linke Teil der Apparatur verwendet mit oben offenem Kühler. Nach Einfüllen von Spiritus bis etwa zur halben Höhe des Kühlers ist alles dicht geblieben. Da es hier erstmal nur um einen kurzen Vorversuch ging, habe ich im Kühlmantel Luft gelassen.
An Stromquelle habe ich kurz mit einem Modellbahntrafo (0-14 V, 8,5 VA) experimentiert, aber dessen Überlastungsschutz führte zu Unterbrechungen alle paar Sekunden. Beim PC-Netzteil war mit 3,3 V überhaupt nichts zu merken, bei 5 V kräftige Gasbildung und Glühen des Wendels. Bei einem früheren Experiment habe ich auch mal 12 V an einer Halogenlampe 12 V 50 W probiert: nach paar Minuten war die Wendel hin. Deswegen dieses Mal nur 5 V. Messung der jeweils tatsächlich anliegenden Spannung mit dem Voltmeter.
Danach habe ich den Gassammler am Liebigkühler angeschlossen, Eimer, den unteren Schlauch und damit den Tropftrichter mit Leitungswasser gefüllt und dann den Eimer so hoch gestellt, dass der Wasserspiegel im Tropftrichter zwischen seinem geöffneten Hahn und dem oberen Schliff lag. Der Dreiwegehahn war dabei geöffnet und wurde erst am Ende geschlossen. Umgebungstemperatur grob 30 °C.

Anschließend wurden für 25 Minuten die 5 V angelegt. Dabei entstanden an der Wendel farblose Gasblasen. Sie glühte dabei leicht, zuerst länger auf der rechten, später auf der linken Seite.

Die gebildete Gasmenge wurde wiederholt im graduierten Tropftrichter abgelesen: 50 ml wurden jeweils in knapp einer Minute gebildet. Zum Ende hin gab es wenig Kondensat am Anfang des gewinkelten Glasrohrs.
Kurz nach Ende des Stromflusses wurde vorsichtig Gas aus dem Dreiwegehahn abgelassen: Es roch angenehm frisch-fruchtig. Könnte man als Mischung von Schnaps und Feuerzeugbenzin beschreiben.
Nach Ausschalten des Stroms wurde das Gas wurde auf 500 ml im Gassammler abgelassen. Danach verringerte sich das Gasvolumen ständig, besonders in den kühleren Nächten überproportional stark. Zwei Tage später waren noch etwa 90 ml übrig. Dieses Gas hatte einen Geruch wie Butangas.
Nach Abbau der Apparatur war zu sehen, dass die Wendel zwischen den Windungen undurchsichtig geworden war.

