([115-95-7], 3,7-Dimethylocta-1,6-dien-3-yl-acetat, Bergamiol)
Linalool und Linalylacetat sind ein Terpenalkohol bzw. sein Ester, die in zahlreichen ätherischen Ölen vorkommen und in der Kosmetik und Parfumindustrie eine große Rolle spielen - man lese nur mal die Inhaltsstoff-Angaben auf diversen Duschgels! Auch im berühmten "Kölnisch Wasser" ist Linalylacetat die wesentlichste Duftkomponente. In großer Menge findet man sie natürlich vorkommend z.B. als Hauptbestandteile des Lavendelöls.
Linalool ist als tertiärer ungesättigter Alkohol gar nicht so leicht zum Ester umzusetzen. Etwas Säure - und schon kommt es zu Umlagerungen zu Geraniol, Neroliol, Ocimenol und Terpineol. Etwas zu wasserentziehend - und schon dehydratisiert es zu Terpinolen und Ocimen, um nur ein paar erste mögliche Produkte zu nennen. All diese Produkte haben sehr ähnlich liegende Siedepunkte und Eigenschaften, sind also schwer zu trennen, allenfalls durch Säulenchromatographie. Als technisch bedeutsame Substanz gibt es natürlich einige Wege wie die Veresterung doch bewerkstelligt werden kann - oft unter niedrigen Ausbeuten. Da großtechnisch bei der Aufarbeitung das unumgesetzte Linalool einfach wieder eingesetzt wird, ist das nicht so ein großes Problem und möglicherweise kostengünstiger als andere Verluste oder teure Chemikalien.
An möglichen Synthesewegen spezifisch für Linalylacetat findet man in der Literatur bzw. in Patenten zum Beispiel:
* Umsetzung mit 2 bis 3-fachem Überschuss Essigsäureanhydrid + 0,05 - 0,25 % p-Toluolsulfonsäure als Katalysator bei Raumtemperatur oder leichtem Erwärmen - 55 % Ausbeute
* Umsetzung mit Essigsäureanhydrid mit <1 % Phosphorsäure als Katalysator, 2 h bei 38-40 °C, 12 h bei Raumtemperatur - "almost complete"
* Verdünnen mit Xylol 1:4, Umsetzung mit Essigsäureanhydrid + Natriumacetat als Katalysator, unter Rückfluss 7 h kochen (keine Angabe der Ausbeute)
* Unter reduziertem Druck (ca 300 mBar) mit Essigsäureanhydrid unter Rückfluss kochen bzw. entstehende Esigsäure ständig langsam destillativ entziehen
Es gibt auch zahlreiche Publikationen die sich generell mit dem Thema Acetylierung beschäftigen bzw analytische Methoden zur Bestimmung von Hydroxylgruppen die von Essigsäureanhydrid + Pyridin oder N,N-Dimethylanilin ausgehen (und entweder den Überschuss Anhydrid direkt rücktitrieren oder den Ester verseifen). Stark riechende tertiäre Amine wie Pyridin können aus geruchlicher Sicht eine störende Komponente in das Produkt einbringen.
Darauf basierend wurden diverse synthetische Ansätze im Reagenzglasmaßstab gestestet (Ansatzmenge mit 3 ml Linalool, Test mit DC, Vergleichssubstanz natürliches Lavendelöl) - alle hatten letztendlich ihre Tücken. Entweder war die Umsetzung nicht sehr zufriedenstellend oder Nebenprodukte durch Umlagerung waren in großer Menge vorhanden - meist beides. Die analytischen Methoden versprechen zwar eine gute quantitative Umsetzung, aus synthetischer Sicht setzen sie jedoch verschwenderische Überschüsse an Reagenz ein.
Die hier dargestellte Methode stellt einen einen guten Kompromiss dar. Sie ergibt mit moderatem Überschuss an Reagenz eine gute Umsetzung bei vor allem sehr geringem Anteil an Nebenprodukten und kann vermutlich noch weiter optmiert werden.
Geräte:
Rundkolben, Rückflusskühler, Scheidetrichter, Apparatur zur Vakuumdestillation, Vigreux-Kolonne
Chemikalien:
Linalool
Pyridin
Essigsäureanhydrid
Salzsäure
Linalylacetat

Durchführung:
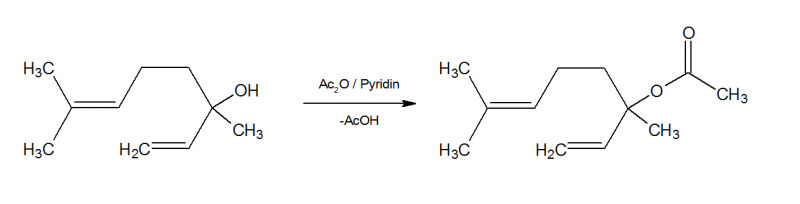
In einem 100 ml-Rundkolben werden 30 ml (0,167 mol) Linalool, 23,8 ml (0,251 mol) Essigsäureanhydrid und 20,3 ml Pyridin (0,251 mol) vorgelegt und mit Rückflusskühler versehen. Die Reaktionsmischung wird nun unter Rühren 12 Stunden auf dem Ölbad bei 140 °C gehalten (ganz leichter Rückfluss, kein Sieden) und auskühlen gelassen. Sie verfärbt sich während dieser Zeit immer dunkler. Nach weiteren 12 Stunden stehen werden dann zur Hydrolyse ca. 40 ml Wasser durch den Kühler hinzugegeben und nochmals unter kräftigem Rühren ca 1 h warm gehalten. Die Reaktionsmischung wird in einen Scheidetrichter überführt und der Kolben zwei Mal mit weiteren ca. 50 ml Wasser gut nachgespült (Waschflüssigkeit ebenfalls in den Scheidetrichter überführen). Nach Trennung der Phasen (wässrige Phase ist unten) wird die wässrige Phase abgelassen und entsorgt. Nun wird zweimal mit ca. 50 ml 2 M Salzsäure gut ausgeschüttelt, um Reste von Pyridin als Hydrochlorid zu entfernen. Nachdem sich die wässrige Phase abgesetzt hat wird sie abgelassen und ebenfalls entsorgt. Rohausbeute: 29,65 g (90,3 % d.Th.)
Die organische Phase wird in einen 50 ml-Rundkolben überführt und eine Apparatur zur Vakuumdestillation mit Vigreux-Kolonne aufgebaut. Bei ca 10 mbar gehen zuerst Reste von Wasser, Pyridin und Essigsäure unter Aufschäumen ab, dann destilliert bei ca 48-49° C eine geringe Menge einer farblosen Flüssigkeit über. Als nächstes gehen bei ca 70-86 °C etwas restliches Linalool und andere Verunreinigungen über (Siedepunkt Linalool bei 10 mBar, mit Antoine berechnet: 74 °C). Aufgefangen wird die Fraktion von 87 - 91 °C (Siedepunkt Linalylacetat bei 10 mBar, mit Antoine berechnet: 91 °C). Der Strom an Destillat nimmt nun rasch ab und es hinterbleibt eine geringe Menge eines dunkelbraunen, flüssigen Sumpfs.
Geprüft wurde die Reinheit des Produkts durch eine DC (Kieselgel 60, Laufmittel Toluol:Ethylacetat 22:3, Sichtbarmachung durch Cer-Ammoniummolybdat-Sprühreagens). Als "Referenzsubstanz" diente dabei natürliches Lavendelöl in dem die beiden größten Spots dem Linalool und Linalylacetat klar zugeordnet werden können. Ebenfalls mit aufgetragen wurden die beiden Fraktionen des Vorlaufs. Es wurde dabei bewusst eine große Menge Produkt aufgetragen um die möglichen Verunreinigungen besser sichtbar zu machen - dementsprechend ist der Fleck des Linalylacetats unverhältnismäßig groß und schlecht aufgelöst.
Im Produkt sind noch zwei kleine Spots zu sehen. Der untere ist klar als Linalool identifizierbar, der obere Spot ist bereits im Vorlauf enthalten und könnte Ocimen entsprechen. Das passt sowohl dazu dass Ocimen eine übliche Nebenkomponente im Lavendelöl ist und dass es leicht durch Dehydratisierung aus Linalool gebildet wird, als auch grob zum Siedebereich des ersten Vorlaufs (dafür konnten keine Antoine-Parameter in der Literatur gefunden werden, Siedepunkt bei Normaldruck 176-178 °C liegt aber 20° unter dem von Linalool). Möglicherweise könnte es sich auch um Myrcen handeln (Kp = 166-167 °C).
Angesichts der nahe beieinander liegenden Siedepunkte ist eine quantitative Trennung nicht leicht zu erreichen, das Produkt ist für praktische Zwecke aber durchaus rein genug (geschätzt >90 %). Linalylacetat ist eine farblose bis schwach gelbliche Flüssigkeit von sehr angenehm würzig-blumigem Geruch nach Lavendel oder Bergamotte. Im direkten Vergleich riecht natürliches Lavendelöl geradezu Terpentin-artig.
Ausbeute: 17,1 g (52,1 % d.Th.)
Entsorgung:
Reste kommen zu den Organischen halogenfreien Abfällen.
Erklärung:
Linalool wird mit Essigsäureanhydrid zum Essigsäureester umgesetzt. Pyridin als Base fängt dabei entstehende Essigsäure ab um säurekatalysierte Umlagerungen zu verhindern.
Bilder:
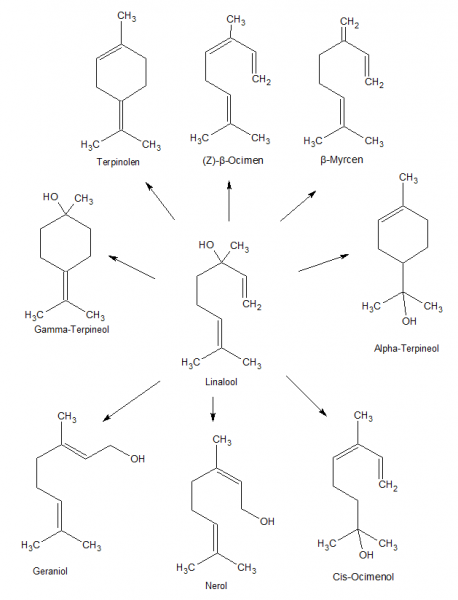
Mögliche Umlagerungsprodukte von Linalool die sich unter Säurekatalyse leicht bilden können

Ansatz nach ca. einer Stunde - erste Verfärbung zu erkennen

Waschen des Rohprodukts mit 2M HCl

Vakuumdestillation des Rohprodukts

Produkt nach der Destillation
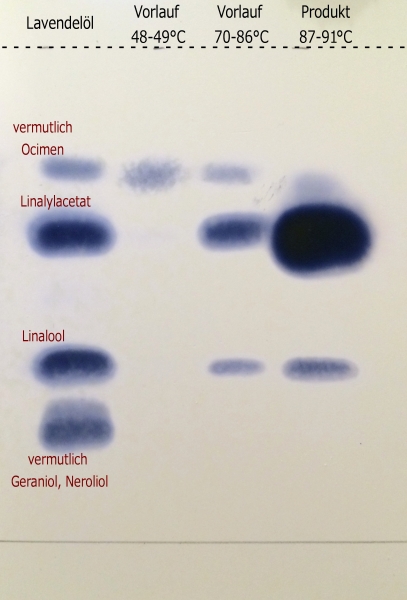
Dünnschichtchromatographie - Parameter siehe oben.