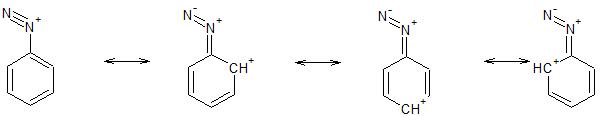Balz-Schiemann-Reaktion
Moderator: Moderatoren
-
Lokoschade
- Illumina-Mitglied
- Beiträge: 27
- Registriert: Sonntag 4. März 2018, 13:21
Balz-Schiemann-Reaktion
Hallo zusammen,
ich bearbeite gerade eine neue Aufgabe:
Zeigen Sie anhand von geeigneten Resonanzstrukturen die Bildung des jeweiligen Produktes sowie, falls notwendig, den Ursprung der Regioselektivität-
Angegeben sind mehrere Reaktionen, aber ich habe Probleme bei folgender:
Umsatz von Anilin mit Natriumnitrit und Fluorwasserstoff in Pyridin.
Ich weiß, dass es sich um die Balz-Schiemann-Reaktion handelt. Aber ich weiß nicht, wie es da mit geeigneten Resonanzstrukturen aussieht. Den Ursprung der Regioselektivität kann ich ja hier ignorieren, weil -NH2 ja durch ein Fluor substituiert wird.
Betreffen die Resonanzstrukturen die Diazotierung?
ich bearbeite gerade eine neue Aufgabe:
Zeigen Sie anhand von geeigneten Resonanzstrukturen die Bildung des jeweiligen Produktes sowie, falls notwendig, den Ursprung der Regioselektivität-
Angegeben sind mehrere Reaktionen, aber ich habe Probleme bei folgender:
Umsatz von Anilin mit Natriumnitrit und Fluorwasserstoff in Pyridin.
Ich weiß, dass es sich um die Balz-Schiemann-Reaktion handelt. Aber ich weiß nicht, wie es da mit geeigneten Resonanzstrukturen aussieht. Den Ursprung der Regioselektivität kann ich ja hier ignorieren, weil -NH2 ja durch ein Fluor substituiert wird.
Betreffen die Resonanzstrukturen die Diazotierung?
-
Glaskocher
- Illumina-Mitglied
- Beiträge: 2543
- Registriert: Dienstag 27. Oktober 2015, 22:17
- Wohnort: Leverkusen
Ich kenne diese Reaktion mit HBF4 statt HF. Das soll hier aber keine Rolle spielen, solange nur "Papierchemie" betrieben wird.
Zeichne mal, der Übung halber, für jeden einzelnen Reaktionsschritt (jede Einzelstufe) alle möglichen Resonanzstrukturen auf. Einige Strukturen ermöglichen die Fortsetzung der Reaktion, andere nicht. ersetze der Einfachheit mal ein "H" am Aromaten durch ein "D", um im Ring die Resonanzstrukturen besser unterscheiden zu können.
Zeichne mal, der Übung halber, für jeden einzelnen Reaktionsschritt (jede Einzelstufe) alle möglichen Resonanzstrukturen auf. Einige Strukturen ermöglichen die Fortsetzung der Reaktion, andere nicht. ersetze der Einfachheit mal ein "H" am Aromaten durch ein "D", um im Ring die Resonanzstrukturen besser unterscheiden zu können.
-
Lokoschade
- Illumina-Mitglied
- Beiträge: 27
- Registriert: Sonntag 4. März 2018, 13:21
-
Lokoschade
- Illumina-Mitglied
- Beiträge: 27
- Registriert: Sonntag 4. März 2018, 13:21
-
Glaskocher
- Illumina-Mitglied
- Beiträge: 2543
- Registriert: Dienstag 27. Oktober 2015, 22:17
- Wohnort: Leverkusen
Eine "Ecke" vom Benzolring deuterieren ist nur dazu da, sie wiedererkennen zu können. Auf Papier reicht es, sie immer mit der selben Nummer zu versehen.
Lasse jetzt mal ein Fluorid-Anion mit jeder der Grenzstrukturen reagieren und male jedes einzelne Umklappen von Elektronenpaaren auf. Du wirst Unterschiede beobachten.
Offtopic: In einem Ansatz, der 2,6-Diisopropylanilin über eine Sandmeyer-Reaktion zu 2,6-Siisopropylbrombenzol umsetzen sollte bekam ich durch einen Überschuß an Natriumnitrit nennenswerte Anteile an 2,6-Diisopropyl-4-hydroxy-brombenzol. Das liegt vermutlich an der Aktivierung der 4-Position und sichtbaren Mengen an NO2 in der Gasphase.
Lasse jetzt mal ein Fluorid-Anion mit jeder der Grenzstrukturen reagieren und male jedes einzelne Umklappen von Elektronenpaaren auf. Du wirst Unterschiede beobachten.
Offtopic: In einem Ansatz, der 2,6-Diisopropylanilin über eine Sandmeyer-Reaktion zu 2,6-Siisopropylbrombenzol umsetzen sollte bekam ich durch einen Überschuß an Natriumnitrit nennenswerte Anteile an 2,6-Diisopropyl-4-hydroxy-brombenzol. Das liegt vermutlich an der Aktivierung der 4-Position und sichtbaren Mengen an NO2 in der Gasphase.
-
Lokoschade
- Illumina-Mitglied
- Beiträge: 27
- Registriert: Sonntag 4. März 2018, 13:21
-
Glaskocher
- Illumina-Mitglied
- Beiträge: 2543
- Registriert: Dienstag 27. Oktober 2015, 22:17
- Wohnort: Leverkusen
-
Lokoschade
- Illumina-Mitglied
- Beiträge: 27
- Registriert: Sonntag 4. März 2018, 13:21