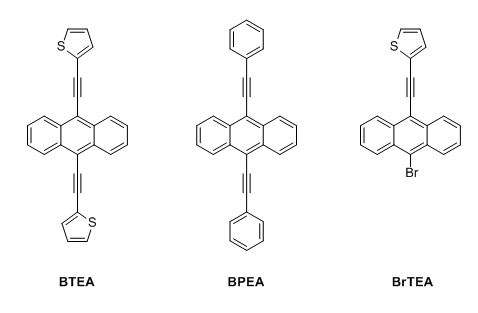
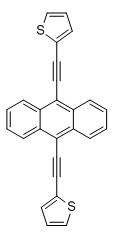
(BTEA, 9,10-Bis(thien-2-ylethinyl)anthracen, 9,10-bis(thiophen-2-ylethynyl)anthracene)
BTEA ist ein Fluoreszenzfarbstoff und weist eine große Ähnlichkeit zum 9,10-Bis(phenylethinyl)anthracen auf, jedoch sind hier keine Phenyl- sondern Thiophen-2-yl-Gruppen (auch Thien-2-yl-, oder 2-Thienyl-) über Ethinylgruppen mit dem Anthracenkern verknüpft. Da die heterocyclischen Fünfringe aromatisch sind, geht vom BTEA eine helle Fluoreszenz aus, die der des BPEA ähnelt. Das UV-Vis Spektrum des BTEA ist dem des BPEA nahezu gleich. Das benötigte 2-Ethinylthiophen wurde in zwei Stufen aus kommerziellen Edukten synthetisiert. Als Nebenprodukt wurde das monoalkinylierte 2-((10-Bromanthracen-9-yl)ethinyl)thiophen (BrTEA) isoliert, welches sich für asymmetrische 9,10-Anthracenylenfarbstoffe eignet oder als eigenständiger Substituent dienen kann.
Geräte:
verschiedene (Mehrhals-)Rundkolben oder Schlenkrohre, Septen, Spritzen, Mikroliterspritze, Magnetheizrührer mit Ölbad, Rückflusskühler, Möglichkeit zur Vakuumfiltration, Rotationsverdampfer, Argon
Chemikalien:
2-Bromthiophen

Trimethylsilylacetylen

Diethylamin


Tetrahydrofuran
Kupfer(I)-iodid


Bis(triphenylphosphan)palladium(II)-chlorid

Dichlormethan
Natriumsulfat, wasserfrei
Kieselgel
Kaliumcarbonat
Methanol
Diethylether
9,10-Dibromanthracen


Salzsäure konz.

Magnesiumsulfat, wasserfrei
Toluol
Hexan



Ethylacetat
Trimethyl(thiophen-2-ylethinyl)silan

2-Ethinylthiophen

9,10-Bis(thiophen-2-ylethinyl)anthracen

2-((10-Bromanthracen-9-yl)ethinyl)thiophen

Hinweis: Vorsicht beim Umgang mit Diethylether, Funkenbildung vermeiden.
Durchführung:
THF und Diethylamin wurden vorbereitend absolutiert: vorgetrocknetes THF wurde über Natrium unter Verwendung eines Metallkühlers refluxiert, das Diethylamin 4 Stunden über gepulvertem Kaliumhydroxid refluxiert und unter Argon abgefüllt.
Trimethyl(thiophen-2-ylethinyl)silan
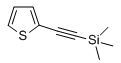
10 mL THF (abs.), 1,06 mL 2-Bromthiophen, 210 mg Pd(PPh3)2Cl2, 30 mg Kupfer(I)-iodid und 1,7 mL Diethylamin (abs.) werden in einem Schlenkrohr entgast und mit 1,8 mL Trimethylsilylacetylen versetzt. Die Lösung wird unter Argon über Nacht bei Raumtemperatur (27 °C, Ölbad) gerührt, anschließend mit 50 mL Wasser versetzt und mit Dichlormethan extrahiert (3 x 40 mL). Die vereinigten Phasen werden mit einer gesättigten Natriumchloridlösung gewaschen und über Natriumsulfat getrocknet. Danach wird das Lösungsmittel unter vermindertem Druck abgezogen. Der ölige Rückstand wird in wenig n-Hexan aufgenommen,über ein kurzes Kieselgelpad filtriert und mit Hexan eluiert. Das Lösungsmittel wird anschließend im Vakuum entfernt und es verbleibt ein leicht gelbliches Öl.
Ausbeute: 1,94 g (98,5 % d.Th.)
2-Ethinylthiophen

1,84 g Trimethyl(thiophen-2-ylethinyl)silan werden in 5 mL Methanol gelöst, anschließend mit 2,88 g fein gepulvertem Kaliumcarbonat versetzt und 30 min bei Raumtemperatur (27 °C, Ölbad) gerührt. Die Mischung wird mit 30 mL Wasser versetzt, gerührt und anschließend mit Diethylether extrahiert (2 x 30 mL). Die vereinigten organischen Phasen werden mit Natriumsulfat getrocknet und das Lösungsmittel im Vakuum abgezogen. Es verbleibt eine braune Flüssigkeit, die zur weiteren Aufreinigung destilliert werden kann.
Ausbeute: 997 mg (90,3 % d.Th.)
9,10-Bis(thiophen-2-ylethinyl)anthracen
In einem Schlenkrohr werden 444 mg 9,10-Dibromanthracen, 37 mg Kupfer(I)-iodid und 92 mg Pd(PPh3)2Cl2 in 15 mL Diethylamin (abs.) vorgelegt und entgast. Dann werden 277 µL 2-Ethinylthiophen zugespritzt, die Lösung 30 min bei Raumtemperatur (27 °C, Ölbad) gerührt und anschließend 13 Stunden im Ölbad auf 70 °C erhitzt. Die abgekühlte Lösung wird vorsichtig (!) in 50 mL Salzsäure (15%) getropft (starke Hitzeentwicklung) und anschließend mit Dichlormethan extrahiert (4 x 30 mL). Die vereinigten organischen Phasen werden über Magnesiumsulfat getrocknet, über ein Kieselgelpad filtriert und mit Dichlormethan eluiert. Anschließend wird das Lösungsmittel im Vakuum entfernt, der verbleibende Feststoff an Kieselgel gebunden und säulenchromatografisch gereinigt (Hexan - Hexan/Ethylacetat 4:1). Dabei eluiert zuerst Dibromanthracen, anschließend das monoalkinylierte Nebenprodukt (BrTEA), gefolgt vom Hauptprodukt. Die Hauptfraktion wurde aus Toluen kristallisiert.
Ausbeute:
BTEA: 1. Fraktion 50,8 mg (9,8 % d.Th.)
BrTEA: 42,6 mg (8,9 % d.Th)
Entsorgung:
Die Lösungsmittel werden soweit möglich recycelt, andernfalls in die entsprechenden halogenfreien oder halogenhaltigen Abfälle gegeben. Kontaminiertes Kieselgel wird gesondert entsorgt. Die wässrigen Phasen wird den wässrigen kontaminierten Abfällen oder dem Schwermetallabfall zugeführt. Die halogenierten Edukte oder Nebenprodukte werden dem halogenhaltigen Abfall zugeführt. Das Produkt wird aufgehoben oder dem halogenfreien Abfallzugeführt.
Erklärung:
Mit der Sonogashira-Hagihara-Kupplung können nicht nur Arylalkine an Haloaromaten gekuppelt werden sondern auch andere terminale Alkine. Dabei ist Trimethylsilylacetylen (TMSA) neben 2-Methyl-3-butin-2-ol in der organischen Synthese das wichtigste Acetylenäquivalent. Beide sind flüssig und damit besser handhabbar als Acetylen und darüber hinaus monofunktional, so dass gezieltere Monosubstituionen möglich sind und keine Doppelsubstitutionen und Probleme mit der Dosierung von Gasen auftreten. Die beiden terminalen Alkine lassen sich in palladiumkatalysierten Kupplungsreaktionen leicht an Aromaten binden, welche nach Abspaltung der Schutzgruppe als freies Arylalkin vorliegen und sich für weitere Reaktionen eignen. Somit ist es möglich, beliebige Haloaromaten (bevorzugt Brom- oder Iodaromaten) über Ethinylbrücken zu verknüpfen. Diese Vorgehensweise wird auch genutzt um das 2-Ethinylthiophen zu synthetisieren. Nach Abspaltung der TMS-Schutzgruppe liegt das terminale Alkin vor und wird in einer zweiten Sonogashira-Kupplung mit 9,10-Dibromanthracen zum BTEA umgesetzt.
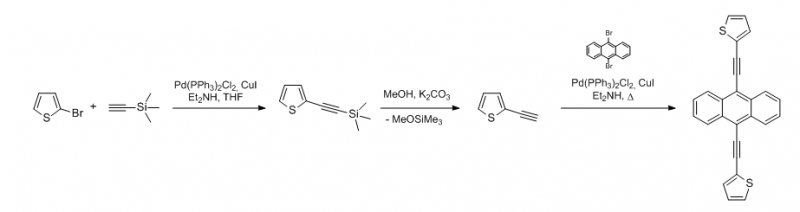
Die schlechte Ausbeute und die Bildung größerer Mengen BrTEA könnte mit den nicht optimierten Reaktionsbedinungen oder ungenügend reinem 2-Ethinylthiophen zu erklären sein.
Bilder:

Umlaufapparatur mit getrocknetem Diethylamin

Beendete Reaktion zum TMS-geschützen Ethinylthiophen

Isoliertes Trimethyl(thiophen-2-ylethinyl)silan

Entschützung

Isoliertes, nicht destilliertes 2-Ethinylthiophen

BTEA-haltige Lösung nach Reinigung über ein Kieselgelpad

Rohes BTEA (enthält noch Edukt und monoalkinyliertes Nebenprodukt)

Säulenchromatographie

Dibromanthracen eluiert

BTEA eluiert

Isoliertes BrTEA

BTEA nach Kristallisation aus Toluol
Mein Dank gilt Stepfan für die gute Zusammenarbeit.