Der Alltag scheint das genaue Gegenteil zu einem spannenden Experiment zu sein. Aber auch hier gibt es ungelöste Probleme und Fragestellungen, die mit Chemie zu tun haben. Viele davon finden sich in der Küche.
Meine Frau hat ein paar traditionsreiche Küchentricks auf Lager, deren chemische Grundlage mir immer unklar war. Einer davon ist, wie man eine versalzene Suppe (oder Nudelsoße) “entsalzt“: man nimmt eine rohe Kartoffel, schält sie, schneidet sie in der Mitte durch, kocht sie in der zu entsalzenden Speise weich und nimmt sie dann wieder heraus. Die Kartoffel, so erklärte sie mir, zöge das Salz aus der Suppe. Bei einer geschmacklichen Prüfung des Ergebnisses dieser Prozedur fand ich, dass die Suppe danach tatsächlich weniger salzig schmeckt, als zuvor.
Nun schätze ich die Kochkunst meiner Frau und bin ihr - vorsichtig ausgedrückt – doch sehr zugeneigt. Das sind zwar gute Voraussetzungen für eine Beziehung, aber schlechte für eine objektive Beurteilung der Frage ob die Kartoffel die Suppe tatsächlich entsalzen kann. Daher habe ich den Küchentrick einer wissenschaftlich-objektiven Prüfung unterzogen
Fragestellung:
Nimmt der Salzgehalt einer Lösung ab, wenn man eine Kartoffel darin kocht? Hypothese: die Kartoffel könnte als Ionenaustauscher wirken. Alternativhypothesen: die Kartoffel nimmt einfach Salzlösung durch Quellung in sich auf. Oder die Geschmacksverbesserung beruht auf anderen Einflussfaktoren und hat gar nichts mit einer Veränderung des Salzgehaltes zu tun.
Material und Methoden:
Es wurde zunächst eine Kochsalzlösung hergestellt, indem schrittweise (in Portionen von 0,5 %) Natriumchlorid in destilliertem Wasser gelöst wurde. Nach jedem Schritt wurde der Geschmack der Lösung getestet. Sobald ein “versalzener“ Geschmack erreicht war wurde der Gehalt in einem Aliquot von 5 ml maßanalytisch nach Mohr (Anleitung) bestimmt. In die Salzlösung (500 oder 1000 ml) wurde eine mittelgroße rohe, geschälte Kartoffel (Sorte: überwiegend festkochend), die einmal halbiert worden war, gegeben. In einem gewöhnlichen Kochtopf (um realitätsnahe Bedingungen zu erzielen) wurde die Kartoffel in der Lösung 30 Minuten gekocht und dann abkühlen gelassen.

Abb.1: Versuchsaufbau
Nach dem Abkühlen wurde sorgfältig abgegossen und unter Nachspülen des Topfes auf das Ausgangsvolumen (500 oder1000 ml) aufgefüllt und dann der Gehalt in 5 ml nach Mohr titriert. Die zunächst geplante Bestimmung nach Fajans (Anleitung) war nicht möglich, da sich in der behandelten Lösung ein sehr schleppender Umschlagspunkt ergab.

Abb.2: Titration nach Mohr
Aus dem Volumen und der Konzentration der Lösungen vor und nach dem Versuch wurde die vorhandene Gesamtmenge an Salz – als Natriumchlorid – berechnet und miteinander verglichen. Der Versuch wurde im ganzen vier Mal durchgeführt. Bei den letzten Versuchen wurde auch das Gewicht der Kartoffel vor und direkt nach dem Versuch ermittelt.
Ergebnisse:
Bei einem Gehalt von 0,5% NaCl empfand ich den Geschmack der Lösung als fade, bei 1 % als angenehm (vielleicht ein kleines bisschen zu stark gesalzen) und bei 1,5 % als deutlich versalzen.
Der Salzgehalt der Lösung zu Versuchsbeginn wurde mit dem Ausgangsvolumen, abzüglich 5 ml der zur Titration verwendeten Probe multipliziert, um die gesamte eingesetzte Kochsalzmenge zu errechnen.
Bei einem Vorversuch mit 1000 ml Flüssigkeit in einem kleinen Topf kam es zu nicht näher bestimmbaren Verlusten von Salzwasser durch Überkochen zwischen dem Topfrand und dem Deckel, so dass für die hier ausgewerteten Versuche das Kochen in 1000 ml in einem hohen Topf durchgeführt wurde
Die Ergebnisse entnehme man der Tabelle 1.
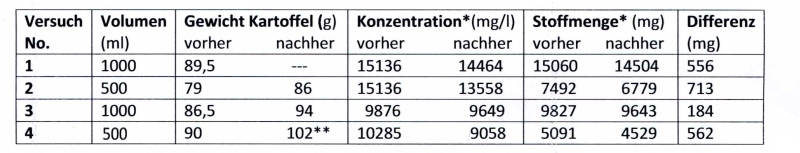
Tabelle 1: Analysenergebnisse
*berechnet als NaCl (58,44 g/mol)
**die Kartoffel zerfiel in mehrere Stücke
Bei einer Geschmacksprobe empfand ich die mit der Kartoffel behandelten 1,5 %igen Salzlösungen als immer noch zu salzig. Im Vergleich mit einer unbehandelten schmeckte die behandelte Lösung jedoch etwas milder.
Qualitative Zusatzanalysen:
Kleine Proben der zuletzt resultierenden Flüssigkeit wurden mit 0,1N Iodlösung sowie mit einer 3 %igen Lösung von Natriumtetraphenylborat versetzt. Als Vergleichslösung diente jedes Mal eine Probe einer 1,5 %igen Salzlösung.

Abb.3: Stärkenachweis (links: Ausgangslösung – rechts: behandelte Lösung)

Abb.4: Kaliumnachweis (links: Ausgangslösung – rechts: behandelte Lösung)
Diskussion:
Bei dieser prospektiv durchgeführten Untersuchung ließ sich durch halbstündiges Kochen mit einer rohen Kartoffel eine deutliche Abnahme des Chloridgehaltes der Salzlösung feststellen. Die nach Ersatz des Verdunstungsverlustes auf das Ausgangsvolumen gefundenen Differenzen betrugen bei drei der vier Versuche zwischen 550 und 710 mg Kochsalz, was einer Abnahme der Salzkonzentration von etwa 5 % (bei Einsatz von 1 Liter) bzw. 10-12 % (bei Einsatz in ½ Liter) entspricht. Der Versuch No. 3 fällt aus dem Rahmen, wobei die Ursache unklar ist. Möglich wäre eine andere Kartoffelsorte (alle stammten aus der gleichen Verpackung) oder auch einfach ein Fehler bei der Notierung der Analysenergenisse.
Worauf beruht der entsalzende Effekt der Kartoffel? Eine einfache Aufnahme des Salzwassers durch Quellung reicht nicht aus, um den Effekt zu erklären, denn dann müssten in den Versuchen No. 1,2 und 4 zwischen 36 und 54 ml Salzlösung von der Kartoffel aufgenommen worden sein. Es müssen also Chloridionen von der Kartoffel absorbiert worden sein. Die Eingangshypothese, die Kartoffel sei ein Ionenaustauscher, lässt sich durch die hier vorgelegten Versuchsergebnisse jedenfalls nicht widerlegen.
Allerdings müssen die Versuchsergebnisse unter verschiedenen Gesichtspunkten kritisch betrachtet werden:
1. Es wurde lediglich die Chloridkonzentration der Flüssigkeiten bestimmt. Nach dem Versuch war Kalium in der Lösung nachweisbar. Es ist unklar in wie weit sich die Natriumkonzentration in der Flüssigkeit geändert und ob ein Austausch von Natrium- durch Kaliumionen stattgefunden hat, oder einfach nur Kalium in die Kochflüssigkeit hineindiffundiert ist.
2. Es kommt - lässt man gesundheitliche Problemstellungen einmal außer Acht - in der Küche letztlich nicht auf den objektiven Salzgehalt sondern auf den Geschmack der Speisen an. Das hier verwendete Modell ist gegenüber der Realität stark vereinfacht. Eine Suppe oder Soße besteht aus wesentlich mehr Zutaten als Salz, Wasser und Kartoffel.
Die physiologischen Grundlagen der Geschmackswahrnehmung “salzig“ sind immer noch nicht endgültig aufgeklärt. Der Aufnahme von Natriumionen in die Geschmackszellen kommt eine unbestreitbare Bedeutung zu – was auch physiologisch sinnvoll ist, denn für Landlebewesen ist Natrium ein Mangelmineral. Die Identifizierung Natrium-reicher Nahrung ist daher lebensnotwendig. Allerdings schmecken auch andere Chloride salzig, wenn auch nicht im gleichen Ausmaß wie Natriumchlorid. Jeder kann sich davon überzeugen, wenn er eine Probe Ammoniumchlorid oder Kaliumchlorid kostet.
Viel bedeutsamer für unsere Fragestellung ist aber, dass die Geschmackswahrnehmung durch viele andere Einflüsse moduliert werden kann. Zunächst ist der Geschmacksrezeptor für „salzig“ habituierbar. Das heißt, die Intensität der Geschmacksempfindung nimmt bei wiederholter Stimulation ab. Dann wird der Geschmack durch verschiedene Begleitstoffe beeinflusst. Raucher haben ein weniger ausgeprägtes Geschmacksempfinden für Salz, als Nichtraucher. Dieser Befund konnte an Mäusen durch Exposition der Geschmacksknospen gegen Nikotin und Ableiten der Aktionspotenziale der afferenten Nerven objektiviert werden. Neben dem Natriumgehalt hat auch das Vorhandensein bestimmter Anionen einen Einfluss auf das Nervenaktionspotenzial. Kochsalz schmeckt (in äquimolarer Konzentration) salziger als Natriumglukonat und löst eine stärkere Nervenstimulation aus. Für die physiologische Reaktion sind in erster Linie membranständige, epitheliale Na-Kanäle (ENaC) verantwortlich. Diese Kanäle kommen jedoch auf vielen Zellen vor und es wurde gezeigt, dass Kochsalz nicht nur den Salzgeschmack, sondern auch den für Süß, Sauer oder Bitter beeinflusst. So kann man mit Substanzen, die den ENaC blockieren (klassischerweise mit dem Diuretikum Amilorid) nicht nur die Geschmackswahrnehmung für „salzig“ sondern auch für „süß“ vermindern. Es existieren allerdings noch andere, nicht-Amilorid-sensitive, Rezeptoren für den Salzgeschmack, die noch nicht identifiziert sind. Damit nicht genug, existieren im Ganglion geniculi (dem Nervenganglion der Chorda tympani, des Nerven der die Geschmacksrezeptoren der vorderen zwei Zungendrittel versorgt) Neurone die auf “salzig“ spezialisiert sind (“narrowly tuned“) und solche, die daneben auf weitere Geschmacksqualitäten ansprechen (“broadly tuned“), und die auf differente Natriumsalze verschieden reagieren. Noch komplexer wird die physiologische Situation dadurch, dass die Geschmackzszellen schon in der Geschmacksknospe über synaptische Verbindungen miteinander interagieren.
Zusammenfassung:
Das Kochen einer etwa 90 g schweren Kartoffel in 1/2-1 Liter Salzwasser (1-1,5 % NaCl) bewirkt eine Verarmung der Kochflüssigkeit um 550-700 mg Kochsalz. Bei kleineren Volumina an Flüssigkeit und bei nicht zu stark versalzener Suppe (bei 1% NaCl) kann diese Veränderung geschmacklich durchaus wahrnehmbar sein. Wegen der Komplexität der die Geschmackswahrnehmung beeinflussenden Faktoren wird sich jedoch - abgesehen davon, dass “die Geschmäcker“ bekanntlich verschieden sind - die Beurteilung des Geschmacks einer gekonnt zubereiteten Speise auch weiterhin auf subjektive Kriterien stützen müssen.
Literatur:
Bigiani A: Amiloride-sensitive sodium-currents in fungiform taste cells of rats chronically exposed to nicotine; Neuroscience 284 (2015): 180-191
Breza JM, Contreras RJ: Anion size modulates salt taste in rats; Journal of Neurophysiology 106 (2012): 1632-1648
Chandrashekar J et al: The receptos and cells for mammalian taste; Nature 444 ( 2006): 288-294
Roper SD: The taste of table salt; Pflügers Archiv – European Journal of Physiology 467 (2015): 457-463