(O,O'-Dibenzoylweinsäure, 2,3-Dibenzoyl-tartaric acid, O,O'-Dibenzoyl-tartaric acid)
Die Trennung von Racematen spielt in der organischen Chemie eine immer größere Rolle, so werden Wirkstoffe für Medikamente heutzutage überwiegend enantiorein gewonnen, da sich die Wirkung der Antipoden oft unterscheidet − (R)-Adrenalin ist beispielsweise 20-50 mal wirksamer als sein Enantiomer. Um unerwünschte Nebenwirkungen auszuschließen ist es notwendig die Enantiomere getrennt zu untersuchen und ggf. einen enantioreinen Wirkstoff zu vermarkten. Da sich Enantiomere zueinander spiegelbildlich verhalten und daher weitgehend identische Eigenschaften haben, ist es nicht möglich sie durch übliche Verfahren zu trennen. Sie haben gleiche Löslichkeiten, Schmelz- oder Siedepunkte und Polaritäten. Deshalb sind die Enantiomere durch Verfahren wie Umkristallisation, Destillation oder Säulenchromatographie in achiralen Medien weder unterscheid- noch trennbar. Eine Möglichkeit der Trennung besteht jedoch darin, die Enantiomere des Racemats in neue, diastereomere Verbindungen zu überführen, welche sich nunmehr in ihren Eigenschaften unterscheiden. Dazu kann man zu einem Racemat ein enantioreines Molekül (chiral resolution reagent) geben, welches mit den Enantiomeren zwei neue Verbindungen (Salze, Ester,...) bildet die zueinander diastereomer sind, sich in ihren Eigenschaften unterscheiden und somit getrennt werden und nach Entfernung des neu eingeführten chiralen Molekül(-teil)s (Estespaltung,...) als reines Enantiomer des vorigen Racemats isoliert werden können (sog. Racematspaltung). Eine alte und bewährte Methode zur Trennung chiraler Amine (z.B. (±)-Hygrin), ist die Umsetzung mit einem Weinsäure-Enantiomer, wobei sich meist ein schlecht lösliches Salz mit einem der eingesetzten Enantiomere bildet und somit isoliert werden kann. Nach anschließender Aufarbeitung und Entfernung der Weinsäure kann das reine Enantiomer gewonnen werden (im Falle des Hygrins, würde jedoch durch die Aufarbeitung eine erneute Racemisierung eintreten). Die dabei erreichte Trennung ist nicht immer quantitativ, sodass man nur einen gewissen Anteil eines Enantiomers - wenn auch meist sehr rein - aus dem Racemat isolieren kann. Will man beide Enantiomere rein gewinnen ist es daher unter Umständen notwendig jeweils ein Enantiomer der chiral resolution reagent einzusetzen um dabei jeweils einen Anteil eines der Enantiomere aus dem Racemat zu isolieren. Dabei können zusätzliche Aufarbeitungsschritte notwendig werden.
Den Effekt der Diastereomerbildung nutzt man auch in der Analytik um Enantiomere unterschieden zu können, wobei man eine chirale Information in das Analysemedium geben muss, dazu können sog. chiral shift reagents (Shift-Reganzien) oder chirale Säulenmaterialien eingesetzt werden, wodurch Unterschiede der in situ gebildeten Diastereomere untersucht werden können.
Die Zahl der Reagenzien zur Racematspaltung ist recht übersichtlich und diese leiten sich oft von mehr oder weniger einfach zugänglichen Molekülen ab, wobei Derivate der Weinsäure und des Camphers häufig vertreten sind, welche diastereomere Salze mit organischen Basen (z.B. Aminen) bilden. Will man hingegen racemische Säuren trennen eignen sich enantiomerenreine organische Basen wie Strychnin, Brucin oder (Pseudo-)Ephedrin-Derivate.
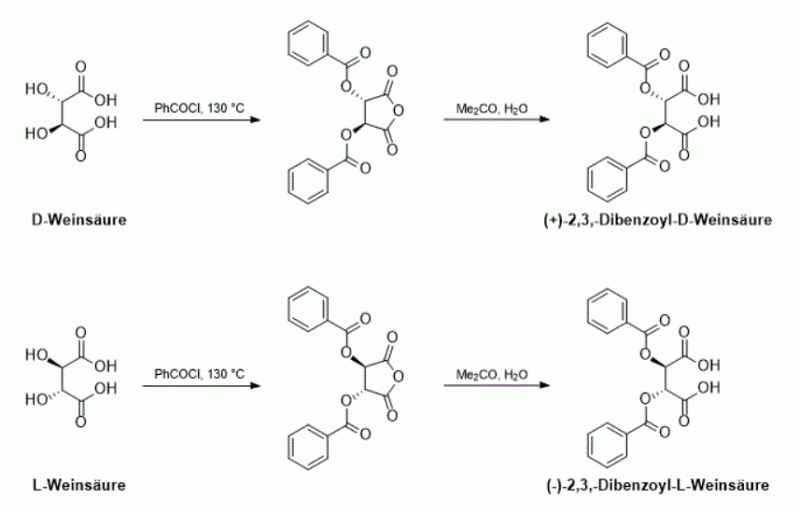
Eines dieser sauren Derivate zur Racematspaltung organischer Basen ist die 2,3-Dibenzoylweinsäure, wobei diese Bezeichnung keine Aussage über die Stereochemie trifft. Hier wird die Synthese von (−)-2,3-Dibenzoyl-L-Weinsäure und (+)-2,3-Dibenzoyl-D-Weinsäure beschrieben, welche leicht in je 2 Stufen aus den enantioreinen Weinsäuren zugänglich sind.
Geräte:
50 mL Rundkolben, 500 mL Rundkolben, Rückflusskühler, Magnetheizrührer mit Ölbad, Möglichkeit zur Vakuumfiltration, Trockenschrank (optional), Destillierbrücke oder Rotationsverdampfer (optional)
Chemikalien:
L-(+)-Weinsäure

D-(-)-Weinsäure
Benzoylchlorid
Diethylether
Toluen
Aceton
2,3-Dibenzoyl-L-Weinsäureanhydrid
2,3-Dibenzoyl-D-Weinsäureanhydrid
(-)-2,3-Dibenzoyl-L-Weinsäure

(+)-2,3-Dibenzoyl-D-Weinsäure

Hinweis: Vorsicht beim Umgang mit heißem Benzoylchlorid.
Durchführung:
2,3-Dibenzoylweinsäureanhydrid:
10 g enantiomerenreine Weinsäure (D-(−)- oder L-(+) Weinsäure) werden in 27 mL Benzoylchlorid vorgelegt und bis zur Verfestigung auf 130 °C erhitzt. Es wird so lange erhitzt bis der Kolbeninhalt nicht mehr rührbar ist (ca. 1-3 h). Nach dem Abkühlen auf Raumtemperpatur wird der Feststoff in ca. 20 mL Diethylether suspendiert, filtriert und mit Diethylether gewaschen (2x15 mL). Anschließend wird aus Toluol umkristallisiert (ca. 200 mL), mit Toluol gewaschen und im Trockenschrank bei 140 °C bis zur Massekonstanz getrocknet.
Ausbeute (2,3-Dibenzoyl-L-Weinsäureanhydrid): 20,0 g (88 % d.Th.)
Ausbeute (2,3-Dibenzoyl-D-Weinsäureanhydrid): 17,4 g (76 % d.Th.)
2,3-Dibenzoylweinsäure:
2,3-Dibenzoylweinsäureanhydrid wird in einem 500 mL Kolben in einer Mischung aus 100 mL Aceton und 50 mL Wasser suspendiert und für eine Stunde zum Sieden erhitzt. Das Aceton wird abdestilliert und die entstehende Emulsion auf 400 mL mit Wasser aufgefüllt. Es wird für 15 min zum Sieden erhitzt und die Mischung unter starkem Rühren auf Raumtemperatur abgekühlt, wobei ein weißer Feststoff ausfällt. Es wird filtriert, mit Wasser gewaschen und im Exsiccator über Calciumchlorid getrocknet.
Ausbeute ((−)-2,3-Dibenzoyl-L-Weinsäure):
Ausbeute ((+)-2,3-Dibenzoyl-D-Weinsäure):
Entsorgung:
Die Lösungsmittel werden recycelt oder dem entsprechenden Lösungsmittelabfällen zugeführt, das Produkt wird aufgehoben oder über den Hausmüll entsorgt.
Erklärung:
Die Angabe (+)- oder (−)- im Namen einer Verbindung dient zur Kennzeichnung des optischen Drehwinkels (mit- oder gegen den Uhrzeigersinn) der Verbindung, ist eine rein experimentelle Beobachtung und lässt sich nicht aus der Struktur einer Verbindung ableiten. Sowohl die R/S-Nomenklatur als auch die Fischer-Projektion hingegen basieren auf einer Konvention, weshalb sich die Stereodisskriptoren R/S bzw. D/L aus der Strukturformel ergeben (D-Weinsäure entspricht 2S,3S und L-Weinsäure entspricht 2R,3R). Während sich die Drehwinkel aus der gesamten räumlichen Molekülstruktur ergeben basieren Stereodiskriptoren nur auf isolierten Stereozentren, daher soll es nicht verwundern, dass aus L-(+)-Weinsäure, welche einen Drehwinkel in Uhrzeigerrichtung aufweist, nach der Veresterung eine Verbindung mit einem Drehwinkel entgegen dem Uhrzeigersinn resultiert. Durch die Veresterung wird die Molekülstruktur drastisch verändert, wohingegen die Stereozentren unbeeinflusst bleiben.
Im ersten Schritt werden Benzoylgruppen eingeführt, wobei sich das Anhydrid der jeweiligen Weinsäure als stabilisierter Fünfring bildet welcher anschließend hydrolysiert wird. Die Anhydride lassen sich gut kristallisieren, wohingegen die freien Säuren oft als Öl anfallen, welches sich verfestigt, daher ist es sinnvoll die Lösung nach der Hydrolyse beim Abkühlen stark zu rühren um die Säuren als feinverteilten Feststoff zu gewinnen. Durch Umkristallisation aus Wasser resultieren die jeweiligen Monoydrate beider Enantiomere und nach Umkristallisation aus Xylen können die wasserfreien Säuren gewonnen werden.
Bilder:

Verfestigter Kolbeninhalt nach Reaktion mit dem Benzoylchlorid

Beide umkristallisierte Anhydride

Vorgelegtes Anhydrid

Klare Lösung vor dem Abrotieren des Acetons

Gebildeter Feststoff nach dem Abkühlen
Mein Dank gilt Xyrofl für die Hilfe bei der Überarbeitung.


