(E)-3-Phenylpropensäure
Zimtsäure ist ein interessantes Edukt für Riechstoffe, wie ihren Estern und Hydrozimtsäure, und bedeutendes Substrat in der organischen Synthese. Neben vielen bereits veröffentlichten, mehrschrittigen Syntheserouten zeichnet sich die Knoevenagel-Doebner-Variante durch hohe Ausbeuten von 85 % [1] und einer Methode aus, die wenig zeitaufwendig ist. Prinzipiell ist die Knoevenagel-Reaktion ein Spezialfall der Aldolkondensation mit stark C-H-aciden Reaktanten. Wird Malonsäure herangezogen, so decarboxyliert das zunächst gebildete gekreuzt-konjugierte Zwischenprodukt zum Cinnamat, welches in der Aufarbeitung Zimtsäure ergibt. Dieser Sonderfall wird als Doebner-Variante bezeichnet. Nachteilig ist der Umgang mit Piperidin.
Geräte:
Magnetheizrührer, Siliconölbad, Magnetfisch, Zweihalskolben mit passendem Tropftrichter und Rückflusskühler (hier: Intensivkühler, aber Dimroth ausreichend), fakultativ Blasenzähler mit durchbohrtem Stopfen, Saugflasche mit Büchnertrichter und Dichtung, Vakuumpumpe, Bechergläser etc. für die Aufarbeitung
Chemikalien:
Benzaldehyd

Malonsäure

Pyridin


Piperidin


Ethanol

Salzsäure

Zimtsäure

Hinweise:
Piperidin ist giftig, Pyridin gesundheitsschädlich, beide Stickstoffbasen riechen unangenehm. Die konzentrierte Salzsäure setzt beim Eingießen gasförmigen Chlorwasserstoff in größeren Mengen frei. Es ist daher mit Handschuhen unter dem Abzug zu arbeiten.
Durchführung:
In einem 500 ml Zweihalsrundkolben werden 31 g Malonsäure in 50 ml trockenem Pyridin (siehe Anm. 1) und 2 g Piperidin vorgelegt. Der Tropftrichter wird mit 26,4 g Benzaldehyd beschickt, vor Beginn wird der Rückflusskühler aufgesetzt. Zunächst wird das Bad angeheizt und die Mischung magnetisch gerührt, bis alle Säure in Lösung gegangen ist. Nun erfolgt die Zugabe des Aldehyds, der Ansatz wird gelinde am Rückfluss erhalten und über einen Blasenzähler kontrolliert, ab wann kein Kohlenstoffdioxid mehr entwickelt wird (siehe Anm. 2). Das Reaktionsgemisch nimmt bis zu diesem finalen Zeitpunkt eine blass gelbe Farbe an. Der Kolben wird abkühlen gelassen und hernach unter starkem magnetischen Rühren in eine Mischung von konzentrierter Salzsäure (Mindestmenge aus genauer Konzentration berechnen) und zerkleinertem Eis (aus Aqua dest.) langsam eingegossen, sodass sich keine größeren Klumpen bilden, die Pyridin einschließen könnten. Der ausgeschiedene, weiße, flockige Feststoff wird abgesaugt. Dieses Rohprodukt riecht noch merklich nach Benzaldehyd. Die Umkristallisation geschieht aus einer Mischung von Ethanol/Wasser 1:3 (siehe Anm. 3), wofür mindestens 200 ml erforderlich sind. Die Säure kristallisiert in langen, weißen Nadeln aus (Fällung durch Stehenlassen im Eisbad für 10 min vervollständigen), die zerdrückt und vakuumfiltriert werden. Aus dem Waschwasser kann bei Anlegen von Vakuum Ethanol abgezogen und so eine 2. Fraktion von etwa 2 g erhalten werden, die genauso rein ist. Das Produkt wird für einige Tage über Silicagel getrocknet (siehe Anm. 4).
Ausbeute: 14,7 g (80 % d.Th.)
Analytik:
Schmelzpunkt = 133 °C (Lit. 135-136 °C)
DC: Das fertige Präparat sowie ein Rückstand der Salzsäure (von der Aufarbeitung) wurden gegen Zimtsäure zur Synthese einer Chromatographie in Ethylacetat unterzogen. Der Rf des Präparats stimmt mit der Referenz überein. Dagegen konnte im Rückstand kein Produkt mehr nachgewiesen werden, was darum interessant ist, da in der Literatur[1] auf ein Ausethern dieses Rückstands zur Verbesserung der Ausbeute Bezug genommen wird. Ich unterstütze diese Empfehlung nicht.
Zimtsäure bildet weiße, nadelförmige Kristalle mit schwach aromatischen Geruch.
Entsorgung:
Alle flüssigen Abfälle gelangen in den flüssigen, organischen, halogenfreien Abfall. Das Produkt wird, falls nötig, mit dem organischen Feststoffabfall entsorgt
Erklärung:
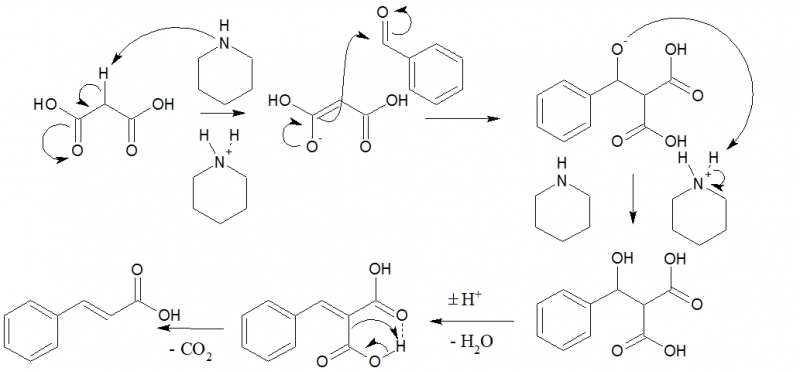
Benzaldehyd setzt sich mit Malonsäure in einer Knoevenagel-Doebner-Reaktion um. Das Piperidin fungiert als basischer Katalysator, das Pyridin regeneriert denselben und ist Solvens. Da der Stickstoff im Piperidin sp³-hybridisiert ist und damit im Gegensatz zum sp²-hybridisierten Pyridin einen stärkeren p-Charakter, mithin höhere Basizität, zeigt, läuft die Reaktion rascher als in Pyridin selbst ab. Mechanismus:
Bilder:

Das Produkt vor dem Trocknen
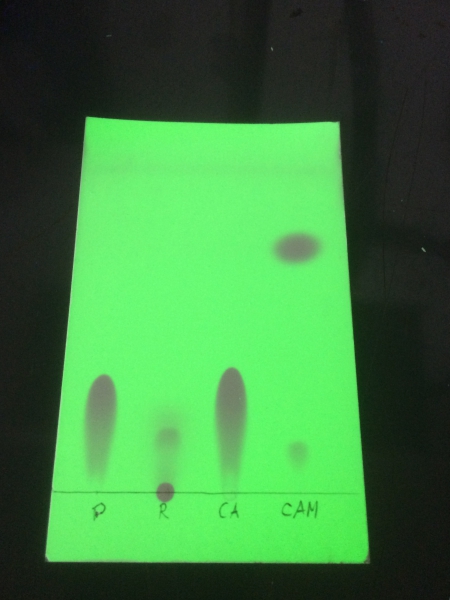
Die TLC-Platte mit Fluoreszenzindikator.
v.l.n.r: Präparat, Rückstand, Referenz, Zimtsäuremethylester, der aus einem Teil des Produkts in einer trivialen Fischer-Veresterung gewonnen wurde.
Literatur:
[1] Organikum 22. Auflage, Weinheim 2004, 527-529