Geräte: 100-mL-Rundkolben, Calciumchlorid-Trockenrohr
Chemikalien:
1,2,4-Triacetoxybenzol
Schwefelsäure konz.

DL-Äpfelsäure

Essigsäureethylester
Aesculetin

Durchführung:
Ein Gemisch aus 4,00 g 1,2,4-Triacetoxybenzol und 3,00 g DL-Äpfelsäure wurde in einem 100-mL-Rundkolben mit 6,1 mL (11,21 g) konz. Schwefelsäure versetzt. Es wurde ein Calciumchlorid-Trockenrohr aufgesteckt und für eine halbe Stunde auf dem kochenden Wasserbad erhitzt. Anschließend wurde das Reaktionsgemisch in kaltem Wasser vorgekühlt und über Eis gegossen (ca. 50 g). Es wurde über Nacht stehen gelassen, wobei sich das stark verunreinigte Produkt in Form eines schwarzen Niederschlags absetzte. Es wurde filtriert und mit Wasser gewaschen.
Das Filtrat wurde mit 3 x 80 mL Essigsäureethylester extrahiert, die organischen Phasen wurden im Scheidetrichter abgetrennt und vereinigt. Dann wurde abdestilliert und der verbleibende Rückstand mit dem zweiten Teil des Produkts (nach verunglückter SC des Filtrationsrückstands) in wenig Methanol gelöst und auf Kieselgel aufgetragen.
Die Probe wurde auf eine Säule (Kieselgel 60, 10-40 μm, ca. 50 g) aufgebracht (es wäre allerdings besser etwas mehr Kieselgel zu verwenden). Es wurde mit DCM/MeOH (19:1) bei ca. 0,7 bar Überdruck eluiert, die erhaltene gelbe Lösung wurde in 8 Fraktionen aufgefangen.
Die Ausbeute wurde nicht bestimmt, lag aber bei zwei Ansätzen jeweils im Milligramm-Maßstab. Angegeben waren 52 % theor. Ausbeute, diese wurden bei weitem nicht erreicht.
Entsorgung:
Das Filtrat des Reaktionsgemischs wird verdünnt in den Ausguss gegeben.
Das Kieselgel mit den stark anhaftenden Verunreinigungen kann in den Hausmüll gegeben werden.
Das Lösemittelgemisch wird entweder zurückgewonnen oder in ein Abfallgefäß für halogenierte organische Lösemittel gegeben.
Erklärung:
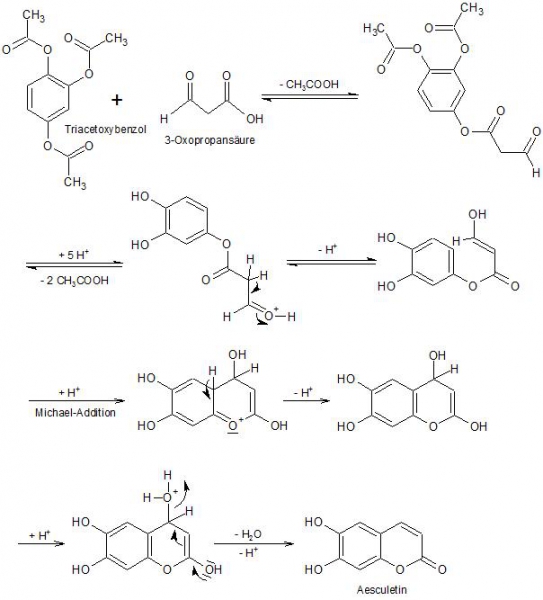
Unter der als Pechmann-Kondensation bezeichneten Reaktion versteht man im Allgemeinen die Synthese eines Cumarins aus einem Phenol und einem β-Ketoester unter Katalyse einer starken Protonensäure.
Im vorliegenden Fall gestaltet sich die Synthese etwas anders, da die theoretisch zu verwendende 3-Oxopropansäure (bzw. deren Ester) nicht stabil ist, die Säure wird also in situ aus der Äpfelsäure unter Abspaltung von Wasser und Kohlenmonoxid gebildet.
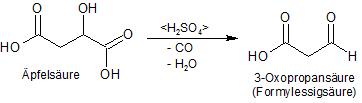
Die gebildete 3-Oxopropansäure reagiert dann mit dem 1,2,4-Triacetoxybenzol unter folgendem Mechanismus zum Aesculetin (6,7-Dihydroxycumarin):
Bilder:

Nach der Schwefelsäure-Zugabe, es erfolgte eine Rotfärbung.

Das Erhitzen auf dem siedenden Wasserbad

Das Produkt über Eis

Der Filtrationsrückstand

Die Probe auf Kieselgel

Säulen bei erhöhtem Druck (Flash-Chromatographie)

Die Fraktionen
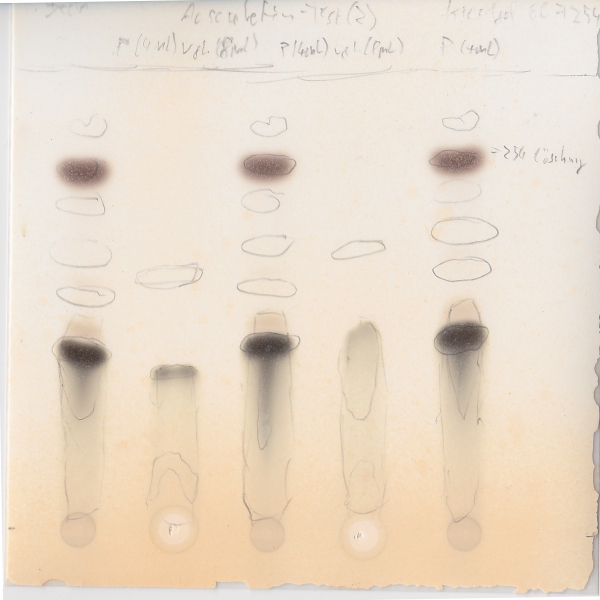
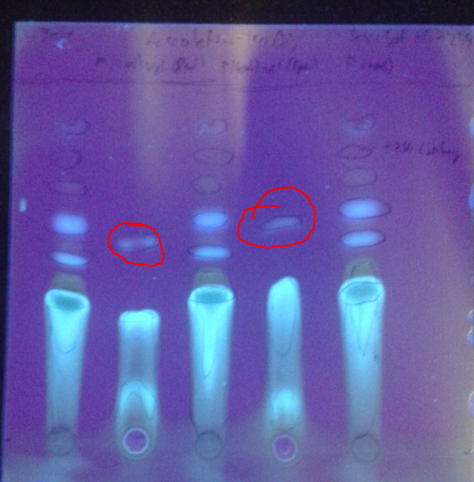
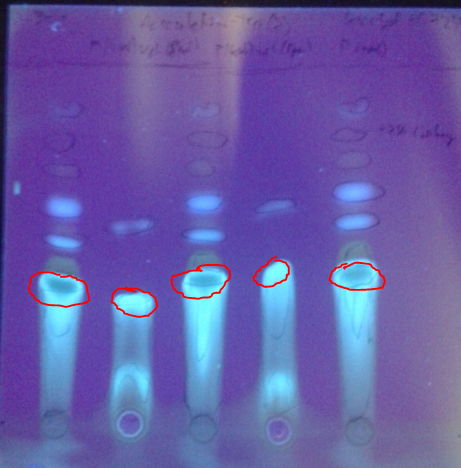
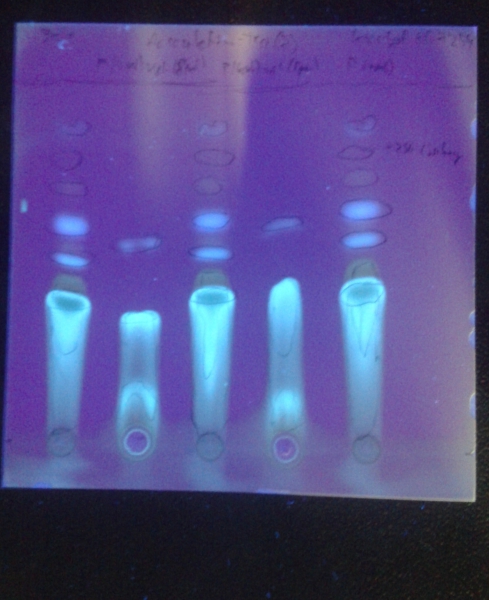
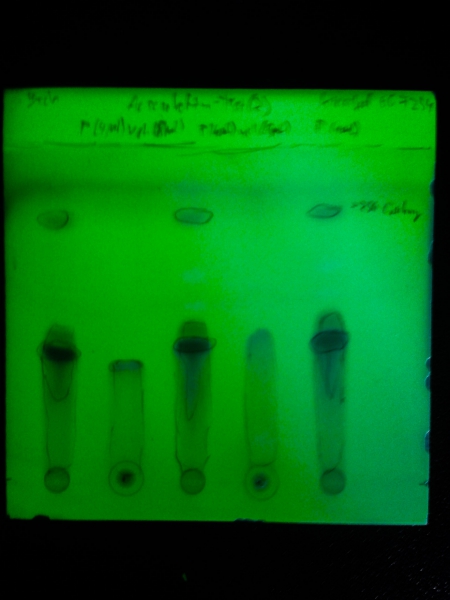
Dünnschichtchromatogramme des Rohprodukts:
Platte: Kieselgel 60 F254
Laufmittel: DCM / MeOH (~19:1)
Substanz 1, 3 und 5: Produkt
Substanz 2 und 4: Ungereinigte Vergleichssubstanz (aus Aesculin durch Glycosidspaltung mit HCl konz.)
Unter Tageslicht:

Unter UV (λ=365 nm):
Unter UV (λ=254 nm):
Nach Besprühen mit Fe3+-Ionen:

Dünnschichtchromatogramme der LC-Fraktionen:
Platte: Kieselgel 60 F254
Laufmittel: DCM / MeOH (~19:1)
Detektion: KMnO4-Lösung

Da Fraktion 1 und 2 deutlich verunreinigt waren, wurden die Fraktionen 3-8 weiter aufgearbeitet.
Quellen:
Ahluwalia, Bhagat, Aggarwal, Chandra: Intermediates for Organic Synthesis, S. 213f
Angew. Chem., Int. Ed. 2013, 52, 9509-9512