Material:
zwei Einweg-Getränkeflaschen aus PET, mit weitem und mit schmalem Hals
große pneumatische Wanne (hier: Aquarium)
diverse Glasröhren, passende Schläuche
Quetschhahn und regulierbarer Schraubklemmenhahn
1,5-Liter-Flasche mit doppelt durchbohrtem Gummistopfen
1-Liter-Erlenmeyerkolben oder andere Flasche
Stativ
Reagenzgläser mit Stopfen
Trichter mit Filter
Chemikalien:
Kaliumpermanganat
Natronlauge 20%
Calciumhydroxid

Schwefelsäure 25%

Kaliumhexacyanoferrat-II
Wasserstoffperoxid 3%

Bleiacetatpapier
Sicherheitshinweise:
Bei den Versuchen sollte eine Schutzbrille getragen werden
Versuche:
Zunächst einmal musste ich das Sumpfgas auffangen. Im Rokoko ging man dabei nach einer Veröffentlichung des holländischen Arztes und Naturforschers Jan Ingenhousz aus dem Jahre 1784 so vor:
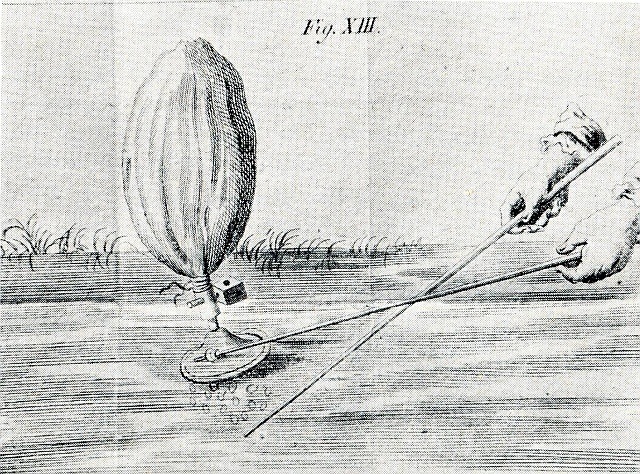
"Eine leichte Art, der brennbaren Luft sumpfichter Wässer habhaft zu werden, ohne daß man einen kleinen Nachen nötig hätte oder sich zu beschmieren Gefahr liefe…“ (aus Krätz, siehe Literatur)
Im 21. Jahrhundert benutzt man andere Methoden. Aus den Überbleibseln der modernen Konsumgesellschaft, die sich an jedem Badesee finden, habe ich mir ad hoc eine Vorrichtung gebastelt, mit der ich das Gas unter Wasser auffangen konnte: Eine große leere PET-Getränkeflasche mit weitem Hals dient als Sammelgefäß. Von einer zweiten Flasche mit engem Hals habe ich das oberen Ende abgeschnitten und quasi als Trichter verwendet.

Ich habe mich also mit meinen „Gerätschaften“ in den See begeben wie in eine überdimensionierte pneumatische Wanne und unter Wasser das vom Boden aufsteigende Gas aufgefangen. Dazu muss man natürlich eine Schwimmbrille tragen. Dabei fiel mir auch der Geruch des Sumpfgases auf, der nicht etwa faulig ist, sondern eher schwach an Teer erinnert. Nach einer gefühlten Ewigkeit, während der es mir ziemlich kalt wurde (es war wohl etwa eine halbe Stunde), hatte ich 1,5 Liter Sumpfgas aufgefangen. Die Flasche habe ich unter Wasser verschlossen und dann zu hause kopfüber in eine geräumige pneumatische Wanne gestellt.

Darüber, wie ich jetzt weitermachen würde, habe ich erstmal eine Nacht geschlafen. Am nächsten Morgen fiel mir folgendes ein. Hier meine Gasometervorrichtung:

Rechts steht eine 1,5-Liter-Flasche, die mit einem doppelt durchbohrten Gummistopfen dicht verschlossen ist. Durch die eine Bohrung des Stopfens führt ein kurzes Glasröhrchen, das direkt an der Stopfenunterseite endet und über einen Schlauch, der einen regulierbaren Schraubklemmhahn trägt, mit einem weiteren Glasrohr verbunden ist, das in die pneumatische Wanne taucht. In der zweiten Öffnung steckt ein langes, bis zum Boden der Flasche reichendes Glasrohr, das über einen langen Schlauch mit Quetschhahn ebenfalls mit einem langen Glasrohr verbunden ist, welches über die eine Öffnung eines weiteren doppelt durchbohrten Stopfen in den Erlenmeyerkolben links eingeführt wird. Die zweite Öffnung bleibt frei (der Stopfen dient am Erlenmeyerkolben nur als Halterung und könnte auch weggelassen werden).
Als erstes wird die Flasche vollständig und der Erlenmeyerkolben zu ca. ¼ mit Wasser gefüllt. Dann öffnet man die Hähne, saugt am kurzen Schlauch (links) an, bis auch die letzten Reste Luft aus der Apparatur entfernt sind und schließt den Quetschhahn rechts, während der Schraubhahn offen bleibt.
Jetzt benötigt man die Hilfe eines Assistenten. Das Glasrohr in der pneumatischen Wanne wird unter Wasser in die Flasche mit der Gasprobe eingeführt, wozu man beide Hände benötigt, damit die Flasche nicht umfällt. Nun stellt der Assistent den Erlenmeyerkolben auf den Boden unter dem Experimentiertisch und öffnet den Quetschhahn an der Verbindung zwischen Flasche und Kolben. Das Wasser fließt aus der Flasche in den Erlenmeyerkolben und saugt das Gas in die Flasche (von diesem Schritt habe ich kein Bild, da ich dazu einen weiteren Assistenten benötigt hätte…). Wenn der Erlenmeyerkolben fast voll ist, schließt man den Quetschhahn und zieht das Glasrohr aus der Gasprobe.
Nun stellt man den Erlenmeyerkolben erhöht über dem Experimentiertisch auf, schließt den Schraubhahn am kurzen Schlauch und entfernt den Quetschhahn zwischen Erlenmeyerkolben und Flasche. Man hat nun eine Gasometervorrichtung, aus der bequem, durch vorsichtiges Öffnen des Schraubhahns, das Gas in kontinuierlichem Strom entnommen werden kann. Dabei fließt das Wasser aus dem Erlenmeyerkolben in die Flasche zurück und verdrängt das Gas durch den kurzen Schlauch.

Zunächst habe ich das Sumpfgas langsam durch etwas Kalkwasser perlen lassen. Nach etwa einer Minute trat eine leichte, aber deutliche Trübung auf. Anschließend habe ich als Reagenz eine stark verdünnte alkalische Kaliumpermanganatlösung (Baeyers Reagenz, rechts im Bild) verwendet. Als nach einer Minute keine Entfärbung eintrat habe ich das Einleiten des Gases abgebrochen.

Um abzuschätzen, wie viel Kohlendioxyd in meinem Sumpfgas in etwa enthalten ist, habe ich ein Reagenzglas in einem kleinen Becherglas stehend damit gefüllt und dann das Wasser fast ganz abgesaugt und durch Natronlauge ersetzt. Nach zweistündigem Stehen konnte ich keine Volumenverkleinerung des Gases im Reagenzglas wahrnehmen, der CO2-Gehalt kann also nicht sehr groß sein (geschätzt unter 5%).

Dann habe ich ein Reagenzglas mit dem Gas gefüllt und einen angefeuchteten Streifen Bleiacetatpapier hineingehängt. Auch nach längerer Zeit war keine Verfärbung des Reagenzpapieres zu beobachten.

Aber die eigentliche spannende Frage war natürlich, ob das aufgefangene Gas brennbar ist! Ich habe ein mit Gas gefülltes Reagenzglas mit der Mündung nach unten an eine Spiritusbrennerflamme gehalten und ein kleines Flämmchen überspringen sehen – aber richtig beeindruckend war das nicht. Dann habe ich einfach das Gasaustrittsrohr in eine Stativklemme gespannt, den Hahn geöffnet und ein brennendes Streichholz an die Mündung gehalten. Und siehe da: das Gas brennt mit kaum leuchtender, blau gesäumter Flamme:


Hält man ein großes Becherglas über die Flamme, beschlägt es innen mit Wasser wobei die Flamme rasch erlischt.

Macht man das mit einem 300-ml-Erlenmeyerkolben, den man rasch verschließt und dann etwas Kalkwasser hineingibt, so kann man das bei der Verbrennung gebildete Kohlendioxid durch die sich ausbildende Trübung nachweisen (wobei ich zugestehe, daß der Nachweis nicht so ganz beweiskräftig ist, da das Gas selbst ja auch kleine Mengen CO2 enthält. Man hätte es vorher durch Natronlauge leiten müssen).

Bei mehreren Versuchen, bei denen ich Reagenzgläser nur teilweise mit Sumpfgas gefüllt und dann - nach Mischen des Gases mit Luft – dieses entzündet habe, habe ich keine Verpuffungen auslösen können. Wahrscheinlich habe ich doch zu viel Sumpfgas verwendet (siehe unten).
Zum Schluss habe ich noch eine Probe des Seebodens untersucht. Etwas davon habe ich mehrmals mit Wasser aufgeschlämmt und abgegossen, um organischen Detritus (Blätter etc.) weitgehend zu entfernen. Zurück bleibt ein heterogenes Gemenge von Sand mit größeren Anteilen feiner schwarzer Körnchen (Becherglas links im Bild). Einen Spatel voll davon habe ich im Erlenmeyerkolben mit Wasser aufgeschwemmt und 25%ige Schwefelsäure zugesetzt. Die Mischung braust auf und es entwickelt sich ein Geruch nach faulen Eiern. Der in das Gefäß gehängte Bleiacetatpapierstreifen färbt sich rasch schwarzbraun (Mitte). Einen Teil dieser Flüssigkeit habe ich dann in ein Reagenzglas filtriert und ein paar Tropfen einer 2%igen Lösung von Kaliumhexacyanoferrat-II sowie etwas Wasserstoffperoxidlösung zugefügt (rechts).

Entsorgung:
Die verwendeten Reagenzlösungen werden über das Abwassernetz entsorgt. Das Gas wird restlos verbrannt.
Anmerkungen:
Im Seegrund wird von Archaebakterien (Archaeen) Methan gebildet. Bei der am weitesten verbreiteten und mengenmäßig vorherrschenden Reaktion wird Kohlendioxid durch elementaren Wasserstoff - beide Ausgangsstoffe entstehen als Stoffwechselprodukte anderer Mikroorganismen – zu Methan reduziert, wobei Energie frei wird, welche die Archaeen für weitere biochemische Stoffwechselprozesse nutzen.
CO2 + 4 H2 ---> CH4 + 2 H2O delta H = -135 kJ
Dieser Prozess – der u.a. auch in den Faultürmen der Kläranlagen abläuft und dem unsere Erdgaslager ihre Entstehung verdanken - ist nur unter streng anaeroben Bedingungen, also bei völliger Abwesenheit von Sauerstoff, möglich. Archaebakterien waren wohl die ersten Lebensformen, die sich auf unserem Planeten bildeten. Sie sind fast sämtlich „extremophil“ - an extreme Umweltbedingungen angepasst. Man findet sie zum Beispiel in heißen Quellen, in Salzseen oder am Grunde der Tiefsee. Eine Kombination extremer Umstände – hoher Druck, hohe Temperatur, niedriger pH, Anwesenheit von für andere Lebewesen toxischen Schwermetallen etc. – findet sich am Meeresgrund in der der Umgebung der sog. „schwarzen Raucher“. Von diesen wird angenommen, daß sie vor etwa 4 Milliarden Jahren die Brutstätte des Lebens darstellten. Die Archaeen sind diejenigen Lebewesen, deren Stoffwechsel aller Wahrscheinlichkeit nach dem der ersten lebenden Zellen auf der Erde am nächsten kommt. Den für das Leben heute so essentiellen Sauerstoff gab es zu dieser Zeit in der Erdatmosphäre noch nicht in nennenswertem Umfang. Er wurde erst im Laufe der nächsten ein bis zwei Jahrmilliarden gebildet, nachdem sich Organismen entwickelt hatten, die Photosynthese betrieben.
Archaebakterien können eine ziemliche Bandbreite einfacher organischer Moleküle (Ameisen- und Essigsäure, Kohlenmonoxid, Methanol, Methylamin, Dimethylsulfid) zu Methan reduzieren. Im Falle des Dimethylsulfids entsteht dabei auch Schwefelwasserstoff, wobei die Energieausbeute allerdings etwa 3-fach geringer ist, als bei der o.g. Reaktion:
2 (CH3)2S + 2 H2O ---> 3 CH4 + CO2 + 2 H2S
Das von mir aufgefangene Sumpfgas besteht offenbar größtenteils aus Methan, vielleicht auch anderen gesättigten Kohlenwasserstoffen. Ungesättigte Olefine sind nach dem negativen Ausfall der Baeyer-Reaktion offenbar abwesend. Auch Schwefelwasserstoff kommt darin nicht in freier Form vor. Dagegen enthält das Gas Reste von Kohlendioxyd. Offenbar wird aber Schwefelwasserstoff gebildet und in Form von Eisensulfid im Sediment abgelagert. Daraus kann er mit einer stärkeren Säure frei gemacht und mit Bleiacetatpapier nachgewiesen werden.
FeS + H2SO4 ---> FeSO4 + H2S
Das in Lösung gegangene Eisen wird mit Blutlaugensalz als Berliner Blau nachgewiesen. Übrigens trat in meinem Versuch die Blaufärbung tatsächlich erst nach dem Zusatz von Wasserstoffperoxid auf. Das beweist, daß das Eisen ausschließlich in zweiwertiger Form vorlag – eine Folge der reduzierenden, strikt anaeroben Bedingungen im Seegrund.
Wird Methan an der Luft entzündet, so verbrennt es zu Kohlendioxid und Wasser:
CH4 + 2 O2 ---> CO2 + 2 H2O
Auf ein Volumenteil Methan kommen also 2 Volumenteile Sauerstoff oder 10 Volumenteile Luft. Gemische von Methan und Luft, die zwischen 5,33 und 14,02% Methan enthalten, sind explosionsfähig und haben in Bergwerken als „schlagende Wetter“ häufig zu Unglücken geführt. Bei höherer Konzentration brennt das Gas ruhig ab. Um eine Methanexplosion zu bewerkstelligen, darf man ein Reagenzglas also nur zu 1/10 füllen – vermutlich der Grund für die Fehlschläge, die ich erlebt habe.
Fazit:
Vom Besuch eines Badesees führt eine direkte Verbindung zur Entstehung des Lebens.
Literatur:
Krätz, Otto: Historische chemische und physikalische Versuche; Aulis Verlag Deubner & Co KG, Köln 1979; ISBN 3-7614-0419-0
Raaf, Hermann: Römpp/Raaf – Organische Chemie im Probierglas, 13. Auflage 1975; Kosmos - Franckh´sche Verlagshandlung Stuttgart; ISBN 3-440-04266-9
