Geräte:
Bechergläser, Tropftrichter, Dreihalskolben, Rundkolben, Schliffthermometer, Magnetrührer, Heizpilz, Magnetrührstäbchen, Rückflusskühler
Chemikalien:
Acetanilid

Eisessig
Brom
Natriumdisulfit
Ethanol
Kaliumhydroxid
Cyclohexan
Schwefelsäure
Natriumnitrit
Aktivkohle
4-Bromacetanilid

4-Bromanilin

2,4,6-Tribromanilin



1,3,5-Tribrombenzol

Hinweis: Es muss ein einem Abzug gearbeitet werden!
Durchführung:
4-Bromacetanilid
In einem 250 ml-Becherglas mit Thermometer werden unter Rühren 6,76 g Acetanilid in 50 ml Eisessig gelöst. Dann werden über einen Tropftrichter 25 ml 2 M Bromlösung in Essigsäure in das Reaktionsgemisch gegeben. Dabei wird die Temperatur zwischen 15-20°C gehalten und, wenn nötig, im Eisbad gekühlt. Nach vollständiger Zugabe des Broms wird ohne Kühlung 15 Minuten weiter gerührt.
Durch überschüssiges Brom kann das Reaktionsgemisch noch gelb gefärbt sein. Wenn dies der Fall ist, wird solange Natriumdisulfit zugegeben, bis die gelbe Farbe der Lösung verschwunden ist. Anschließend gießt man auf 250 ml Eiswasser und saugt den ausgefallenen Feststoff im Büchnertrichter ab. Danach wird noch dreimal mit 30 ml Eiswasser gewaschen und im Exsikkator getrocknet.
Ausbeute: 9,6 g (90 % d.Th.)
4-Bromanilin
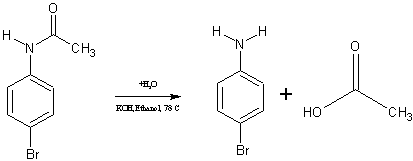
In einen 100 ml-Rundkolben mit Rückflusskühler werden unter Rühren und Erwärmen 8,56 g 4-Bromacetanilid in 30 ml Ethanol gelöst. Man versetzt dieses Gemisch mit einer Lösung aus 8 g Kaliumhydroxid in 15 ml Wasser und kocht anschließend 2,5 Stunden unter Rückfluss. Danach lässt man das Gemisch auf Raumtemperatur abkühlen und versetzt es mit Eisessig bis zu einem pH-Wert von 4.
2,4,6-Tribromanilin
Die zuvor gewonnene Lösung wird nun in einen 250 ml-Dreihalskolben mit Thermometer überführt und im Eisbad auf 5-10 °C gekühlt. Dann wird über einen Tropftrichter eine Lösung von 17,5 g Brom in 15 ml Eissigsäure langsam zugetropft, ohne dass die Temperatur über 15 °C steigt. Nach vollendeter Zugabe des Broms wird ohne Kühlung 15 Minuten weiter gerührt und danach in 200 ml Eiswasser gegossen. Wenn die Lösung noch gelb ist, wird wieder mit Natriumdisulfit entfärbt. Der Niederschlag wird im Büchnertrichter abgesaugt, mehrfach mit Wasser gewaschen und anschließend im Exsikkator getrocknet.
Ausbeute: 6,38 g (48 % d.Th.)
1,3,5-Tribrombenzol
In einem 250 ml-Dreihalskolben mit Rückflusskühler werden 6 g 2,4,6-Tribromanilin unter Erwärmen in 40 ml Ethanol und 10 ml Cyclohexan gelöst. Nachdem sich alles gelöst hat, gibt man 3 ml Schwefelsäure und dann in kleinen Portionen 2,5 g Natriumnitrit zu. Dabei sollte das Gemisch nicht zu stark aufschäumen. Nach vollendeter Zugabe wird noch 1 Stunde unter Rückfluss zum Sieden erhitzt. Nach einer Stunde wird das Gemisch im Eisbad herunter gekühlt und der Niederschlag im Büchnertrichter abgetrennt. Danach wird das Produkt mit 10 %iger Schwefelsäure und Wasser gewaschen und anschließend im Exsikkator getrocknet.
Ausbeute: 1,62 g (28 % d.Th.)
Zur Reinigung löst man das Rohprodukt in siedendem Ethanol, gibt danach 0,5 g Aktivkohle dazu und kocht kurz unter Rückfluss. Danach wird heiß filtriert und das Filtrat im Kühlschrank/Eisbad abgekühlt. Wenn die Kristalisation abgeschlossen ist, wird kalt filtriert und das reine Produkt im Vakuumexsikkator getrocknet.
Ausbeute: 0,50 g (9 % d.Th.)
Entsorgung:
Brom wird mit Natriumdisulfit desaktiviert und kann dann stark verdünnt ins Abwasser gegeben werden. Essigsäure, Schwefelsäure und Kaliumhydroxid werden neutralisiert und ebenfalls verdünnt ins Abwasser gegeben. Natriumnitrit wird zu den anorganischen Feststoffabfällen gegeben, alle anderen Stoffe werden zu den organischen Feststoffabfällen gegeben.
Erklärung:
Im ersten Schritt findet eine einfache elektrophile Substitution mit Brom statt. Das geht auch ohne Katalysator, da Acetanilid ein sehr reaktiver Aromat ist. Durch die Aminogruppe wird der Substituent (Brom) hauptsächlich in die ortho-Stellung dirigiert. Die Aminogruppe selbst wird hier durch die Acetylgruppe geschützt.
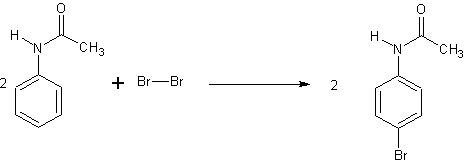
Danach wird im Alkalischen durch Hydrolyse des 4-Bromacetanilids die Acetylgruppe wieder abgespalten und es bildet sich das gewünschte 4-Bromanilin.
Der dritte Schritt besteht darin, das 4-Bromanilin weiter zum 2,4,6-Tribromanilin zu bromieren. Dies gelingt, indem man Brom in einem gewissen Überschuss einsetzt und somit eine vollständige Bromierung erreicht. Die Substitution findet hier wieder elektrophil statt. Durch die schon vorhandene Aminogruppe und das substituierte Brom werden die beiden Brom-Atome so dirigiert, dass sich hauptsächlich die symmetrische Variante des Tribromanilins bildet.
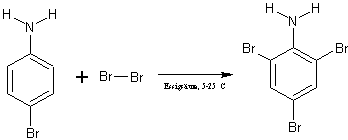
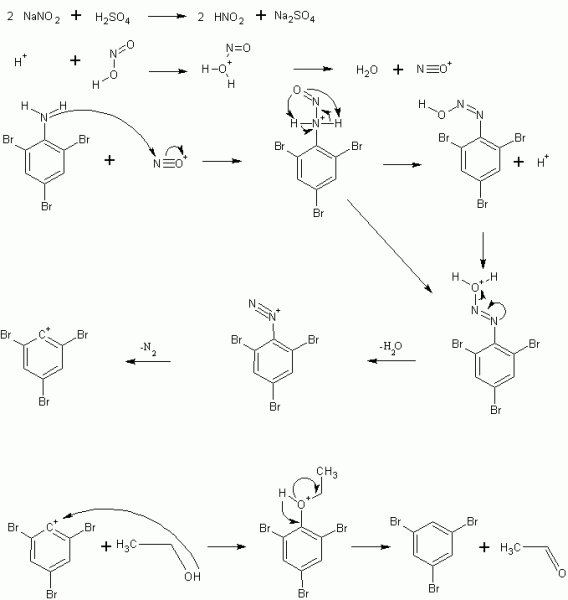
Im letzten Schritt findet eine znächst eine Diazotierung statt. Als Erstes bildet sich aus Schwefelsäure und Natriumnitrit die für die Reaktion benötigte Salpetrige Säure. Diese wird anschließend protoniert, worauf unter Wasserabspaltung ein elektrophiles Nitrosylkation ensteht. Durch das freie Elektronenpaar an der Aminogruppe greift diese das positiv geladene Stickstoffatom des Nitrosylkations an. Durch Deprotonierung und die Umlagerung eines der Wasserstoffatome kommt es zur Bildung eines Diazohydroxids und eines Protons, welches aber wiederum im nächsten Schritt das Sauerstoffatom des Diazohydroxids protoniert. Unter Abspaltung von Wasser kommt es zur Bildung eines Diazoniumkations, welches in der Hitze der Reaktion unter Stickstoffabspaltung wiederum zum Tribromphenylkation umgewandelt wird. Das Tribromphenylkation entzieht dem Ethanol ein Hydridion, wobei sich 2,4,6-Tribrombenzol und Acetaldehyd bilden.
Bilder:

Bromierung vom Acetanillid zum 4-Bromacetanilid

Ausgefallenes 4-Bromacetanilid

Trockenes 4-Bromacetanilid

Syntheseapparatur für 4-Bromanilin

Syntheseapparatur für 2,4,6-Tribromanilin

Ausgefallenes 2,4,6-Tribromanilin

Abgenutschtes 2,4,6-Tribromanilin

Syntheseapparatur für 1,3,5-Tribrombenzol

Rohprodukt der 1,3,5-Tribrombenzolsynthese

Trockenes, umkristallisiertes 1,3,5-Tribrombenzol
