Beim Suchbegriff "ascorbic acid vanillin" in Google kommt man da automatisch draufNI2 hat geschrieben:Und ich hab mir mal deinen Blog angeschaut
Reaktion von Ascorbinsäure mit Vanillin als Lösungsmittel
Moderatoren: Moderatoren, Assistenten
Mag sein, ich hab den langen weg über die SS2S-Seite gewählt 
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
- MarkusB
- Illumina-Mitglied
- Beiträge: 79
- Registriert: Samstag 12. November 2011, 03:14
- Wohnort: Shanghai
Habe gestern abend mal mit verschiedenen Stoffmengen von Vanillin und Ascorbinsäure experimentiert. Bei einer Mischung von 1 g Vanillin und 4 g Ascorbinsäure trat die Grünfärbung bereits wesentlich schneller und schon bei 100 °C auf. Dies lässt den Schluß zu, dass für die Farbreaktion der Luftsauerstoff (oder -stickstoff?) benötigt wird. Ist die Stoffmenge von Vanillin wesentlich größer als die von Ascorbinsäure, sinkt die Ascorbinsäure beim Schmelzen des Vanillins zu Boden des Becherglases und ist komplett von flüssigem Vanillin überdeckt, ergo vom Luftsauerstoff abgeschnitten (nur durch ständiges Rühren kommt Luft in die Schmelze). Die malachitgrünen Kristalle lösen sich dann im Vanillin auf und färben die ganze Schmelze grün. Werden die malachitgrünen Kristalle anstelle des Vanillins in reinem Ethanol, Methanol oder dest. Wasser gelöst, färbt sich die Lösung auch bei hoher Konzentration nicht grün sondern gelblich-braun. Kann sein, dass der grüne Farbstoff in diesen Lösungsmitteln sofort wieder zerfällt .
Ich berichte weiter.
Ich berichte weiter.
"I'm an explorer okay, I get curious about everything and I want to investigate all kinds of stuff." (Richard Phillips Feynman)
- Newclears
- Illumina-Moderator
- Beiträge: 4997
- Registriert: Montag 10. August 2009, 15:48
- Wohnort: Alt-Erschwede
Ich tippe auf den Luftsauerstoff.
unter normalen P/t Verhältnissen ist es nahezu ausgeschlossen, das Stickstoff eine Rolle spielt.
Kann es sein, das ein "scavenger" da intermediär mitspielt? Ich bin eigentlich im Hobby Anorganiker aber das ist echt interessant...
Du hast da ja auch noch solvatochromatische Effekte drin.
Ich denke "Cyan" könnte Dir da helfen. wenn nicht Er, wer sonst
Klingt für mich in dem System nach delokalisierten Elektronen( was sonst ). Hast Du mal die pH Abhängigkeit der Färbung getestet?
). Hast Du mal die pH Abhängigkeit der Färbung getestet?
unter normalen P/t Verhältnissen ist es nahezu ausgeschlossen, das Stickstoff eine Rolle spielt.
Kann es sein, das ein "scavenger" da intermediär mitspielt? Ich bin eigentlich im Hobby Anorganiker aber das ist echt interessant...
Du hast da ja auch noch solvatochromatische Effekte drin.
Ich denke "Cyan" könnte Dir da helfen. wenn nicht Er, wer sonst
Klingt für mich in dem System nach delokalisierten Elektronen( was sonst
"...wie ein Sprecher betont,hat für die Bevölkerung zu keinem Zeitpunkt Gefahr bestanden."
"...mittlerweile rostet das Miststück..." E.v. Däniken
"...mittlerweile rostet das Miststück..." E.v. Däniken
- MarkusB
- Illumina-Mitglied
- Beiträge: 79
- Registriert: Samstag 12. November 2011, 03:14
- Wohnort: Shanghai
Ja, aber es zeigte sich keine Farbänderung der Lösung (zumindest in Wasser, Methanol, Ethanol). Mich erinnert das ganze ein wenig an das Farbverhalten von Iod in Lösung (in sauerstofffreien Lösungsmitteln rosaviolett, in sauerstoffhaltigen Lösungsmitteln braun) Werde mal versuchen, die grünen Kristalle in DCM oder n-Hexan zu lösen. Muss ich aber erst bestellen, hab' da nichts mehr vorrätig.Newclears hat geschrieben:Hast Du mal die pH Abhängigkeit der Färbung getestet?
"I'm an explorer okay, I get curious about everything and I want to investigate all kinds of stuff." (Richard Phillips Feynman)
- MarkusB
- Illumina-Mitglied
- Beiträge: 79
- Registriert: Samstag 12. November 2011, 03:14
- Wohnort: Shanghai
Video
Wie versprochen, hier mal ein Video aus dem die Farbreaktion ersichtlich ist:
Gute Nacht
Gute Nacht
"I'm an explorer okay, I get curious about everything and I want to investigate all kinds of stuff." (Richard Phillips Feynman)
- MarkusB
- Illumina-Mitglied
- Beiträge: 79
- Registriert: Samstag 12. November 2011, 03:14
- Wohnort: Shanghai
An die Organiker:
Kann es sein, dass hier der Vanillinester der der Ascorbinsäure entstanden ist? Es gibt ja zum Beispiel Vanilleester von aliphatischen Säuren als auch Fettsäureester der Ascorbinsäure.
Kann es sein, dass hier der Vanillinester der der Ascorbinsäure entstanden ist? Es gibt ja zum Beispiel Vanilleester von aliphatischen Säuren als auch Fettsäureester der Ascorbinsäure.
"I'm an explorer okay, I get curious about everything and I want to investigate all kinds of stuff." (Richard Phillips Feynman)
- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Halte ich für unwahrscheinlich. Phenole lassen sich i.A. schlecht bis gar nicht mit Carbonsäuren verestern. Ascorbinsäure ist zwar keine Carbonsäure im engeren Sinne, passt aber vom pKs durchaus da rein.
"It is arguably true that the tetrapyrrole system is Nature's most remarkable creation."
- Claude Rimington
- Claude Rimington
- MarkusB
- Illumina-Mitglied
- Beiträge: 79
- Registriert: Samstag 12. November 2011, 03:14
- Wohnort: Shanghai
Im Beyer-Walter Lehrbuch der Organischen Chemie (letzte Auflage 1998) heißt es hierzu: Die Lehrmeinung, Phenylester (Phenolester) ließen sich nicht durch Verestern der Phenole mit Carbonsäuren darstellen, hat sich als Irrtum erwiesen.
Siehe hierzu auch: http://www.chemieonline.de/forum/showthread.php?t=9502
Folgende Idee:
Vanillin wird durch den Luftsauerstoff zu Vanillinsäure oxidiert und anschließend mit Ascorbinsäure verestert. Es entsteht Vanillinsäureascorbylester:
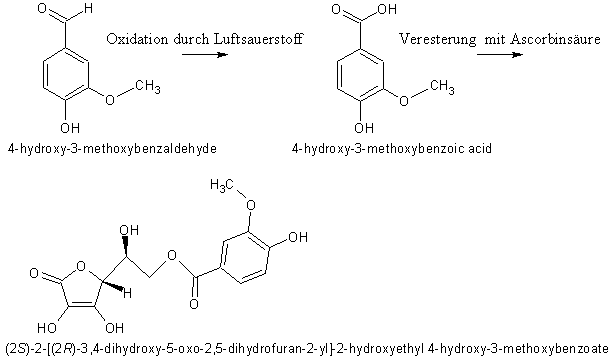
Reaktionsgleichungen:
2 C8H8O3 + O2 → 2 C8H8O4
C8H8O4 + C6H8O6 → C14H14O9 + H2O
3-D-Ansicht mittels ACD/ChemSketch:
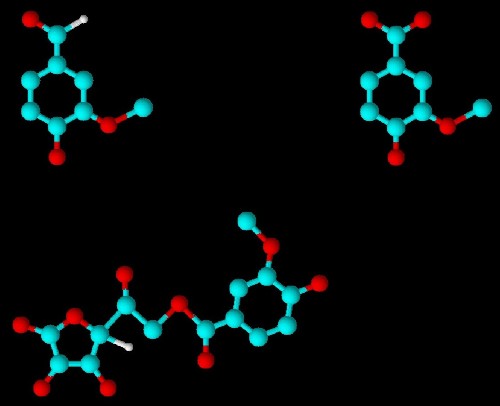
Möglicherweise liegt das als Polyester vor:
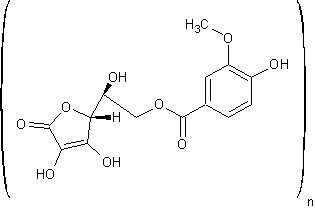
Auf welche Beobachtungen sich meine Theorie stützt:
- Es entsteht eine glasartige, grüne Masse mit honigartiger Viskosität, was auf ein Polyester hinweist (siehe Sorbit-Citronensäure-Polyester: http://www.chemieunterricht.de/dc2/citrone/c_v25c.htm)
- Es entsteht Wasserdampf bei der Reaktion von Vanillin (Vanillinsäure) und Ascorbinsäure
- Luftsauerstoff beschleunigt die Reaktion
- Die Reaktion von Vanillin (Vanillinsäure) und Ascorbinsäure läuft wesentlich schneller und bei niedriger Temperatur ab, wenn annähernd gleiche Stoffmengenanteile vorliegen. Die Reaktionsgleichung sagt 1 Mol Vanillinsäure und 1 Mol Ascorbinsäure voraus. Die molare Masse von Ascorbinsäure mit 176,13 g•mol-1 ist die der Vanillinsäure mit 168,15 g•mol-1 sehr ähnlich
Kann mich natürlich auch total in etwas verrannt haben...
Die Wirkung von L-(+)-Ascorbinsäure im menschlichen Körper ist bekannt. Ebenso ist bekannt, dass sowohl Vanillin als Vanillinsäure antimikrobielle Eigenschaften besitzt. Es ist gegebenenfalls zu untersuchen, welche arzneitechnischen Eigenschaften Vanillinsäureascorbylester, bzw. wenn nicht zutreffend, die beschriebene Verbindung aus Vanillin und Ascorbinsäure besitzt.
Siehe hierzu auch: http://www.chemieonline.de/forum/showthread.php?t=9502
Folgende Idee:
Vanillin wird durch den Luftsauerstoff zu Vanillinsäure oxidiert und anschließend mit Ascorbinsäure verestert. Es entsteht Vanillinsäureascorbylester:

Reaktionsgleichungen:
2 C8H8O3 + O2 → 2 C8H8O4
C8H8O4 + C6H8O6 → C14H14O9 + H2O
3-D-Ansicht mittels ACD/ChemSketch:

Möglicherweise liegt das als Polyester vor:

Auf welche Beobachtungen sich meine Theorie stützt:
- Es entsteht eine glasartige, grüne Masse mit honigartiger Viskosität, was auf ein Polyester hinweist (siehe Sorbit-Citronensäure-Polyester: http://www.chemieunterricht.de/dc2/citrone/c_v25c.htm)
- Es entsteht Wasserdampf bei der Reaktion von Vanillin (Vanillinsäure) und Ascorbinsäure
- Luftsauerstoff beschleunigt die Reaktion
- Die Reaktion von Vanillin (Vanillinsäure) und Ascorbinsäure läuft wesentlich schneller und bei niedriger Temperatur ab, wenn annähernd gleiche Stoffmengenanteile vorliegen. Die Reaktionsgleichung sagt 1 Mol Vanillinsäure und 1 Mol Ascorbinsäure voraus. Die molare Masse von Ascorbinsäure mit 176,13 g•mol-1 ist die der Vanillinsäure mit 168,15 g•mol-1 sehr ähnlich
Kann mich natürlich auch total in etwas verrannt haben...
Die Wirkung von L-(+)-Ascorbinsäure im menschlichen Körper ist bekannt. Ebenso ist bekannt, dass sowohl Vanillin als Vanillinsäure antimikrobielle Eigenschaften besitzt. Es ist gegebenenfalls zu untersuchen, welche arzneitechnischen Eigenschaften Vanillinsäureascorbylester, bzw. wenn nicht zutreffend, die beschriebene Verbindung aus Vanillin und Ascorbinsäure besitzt.
"I'm an explorer okay, I get curious about everything and I want to investigate all kinds of stuff." (Richard Phillips Feynman)
- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Deswegen schrieb ich "i.A." dazu...dass es grundsätzlich doch möglich ist, heißt nicht, dass nicht "extremere" Bedingungen nötig sind, wie z.B. der Zusatz einer vernünftigen Säure als Katalysator. Sowohl Ascorbinsäure als auch Vanillinsäure dürften viel zu schwach sauer sein, um ihre eigene Veresterung zu katalysieren. Unter den Carbonsäuren geht sowas mit Oxalsäure ganz gut, die ist aber auch etwa 1000x stärker sauer als Ascorbinsäure und Vanillinsäure. Der Wasserdampf kann auch aus gebundenem Wasser oder aus Nebenreaktionen stammen; ersteres könnte man z.B. durch längeres Trocknen beider Edukte über P4O10 ausschließen. Die Beschleunigung der Reaktion durch Luftsauerstoff heißt nur, dass allgemein irgendeine Oxidation stattfindet - somit auch Nebenreaktionen.Die Lehrmeinung, Phenylester (Phenolester) ließen sich nicht durch Verestern der Phenole mit Carbonsäuren darstellen, hat sich als Irrtum erwiesen.
"It is arguably true that the tetrapyrrole system is Nature's most remarkable creation."
- Claude Rimington
- Claude Rimington
-
Bariumchlorid
- Illumina-Mitglied
- Beiträge: 1570
- Registriert: Samstag 6. Juni 2009, 21:37
Zur Sache mit der Reaktionsgeschwindigkeit :
Es gilt bei solchen einfachen Veresterungen k = [c(Alkohol)][c(Säure)]. Ein Überschuss an einer Komponente sollte also die Reaktion ebenso schnell ablaufen lassen, jedoch sähe die Konsistenz dann natürlich anders aus.
Zudem ist auch zu bedenken, dass die Ascorbinsäure keine wirklich starke Säure ist...eher würde ich mich auf die Redoxeigenschaften der Edukte konzentrieren, da könnte sicherlich der ein oder andere Prozess der Nebenproduktbildung ablaufen.
Es gilt bei solchen einfachen Veresterungen k = [c(Alkohol)][c(Säure)]. Ein Überschuss an einer Komponente sollte also die Reaktion ebenso schnell ablaufen lassen, jedoch sähe die Konsistenz dann natürlich anders aus.
Zudem ist auch zu bedenken, dass die Ascorbinsäure keine wirklich starke Säure ist...eher würde ich mich auf die Redoxeigenschaften der Edukte konzentrieren, da könnte sicherlich der ein oder andere Prozess der Nebenproduktbildung ablaufen.
- MarkusB
- Illumina-Mitglied
- Beiträge: 79
- Registriert: Samstag 12. November 2011, 03:14
- Wohnort: Shanghai
Danke, Leute. Alles gute Einwände und Vorschläge.
Ich gebe aber nochmals zu bedenken, dass sich auch aus Citronensäure und Sorbit oder Rizinusöl einfach Polyester herstellen lassen. Ascorbinsäure hat einen pKs-Wert von 4,25, Essigsäure einen pKs-Wert von 4,8 und die 3 Säuredissoziationskonstanten der Citronensäure sind pKs1 = 3,13, pKs2 = 4,76 und pKs3 = 6,4.
Es existieren weiter Ester, an denen die Ascorbinsäure beteiligt ist. Beim Lösen in Essigsäure z. B. zerfällt mein Produkt wieder in die Edukte.
Werde jetzt mal das ganze mit Vanillinsäure anstatt Vanillin versuchen, ebenso unter Luftausschluss mit Vanillin und sehen, ob sich noch eine bessere Erklärung findet.
Viele Grüße,
Markus
Ich gebe aber nochmals zu bedenken, dass sich auch aus Citronensäure und Sorbit oder Rizinusöl einfach Polyester herstellen lassen. Ascorbinsäure hat einen pKs-Wert von 4,25, Essigsäure einen pKs-Wert von 4,8 und die 3 Säuredissoziationskonstanten der Citronensäure sind pKs1 = 3,13, pKs2 = 4,76 und pKs3 = 6,4.
Es existieren weiter Ester, an denen die Ascorbinsäure beteiligt ist. Beim Lösen in Essigsäure z. B. zerfällt mein Produkt wieder in die Edukte.
Werde jetzt mal das ganze mit Vanillinsäure anstatt Vanillin versuchen, ebenso unter Luftausschluss mit Vanillin und sehen, ob sich noch eine bessere Erklärung findet.
Viele Grüße,
Markus
"I'm an explorer okay, I get curious about everything and I want to investigate all kinds of stuff." (Richard Phillips Feynman)
- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Womit Citronensäure schonmal 10x stärker als Ascorbinsäure und Vanillinsäure ist und außerdem mit einem aliphatischen Alkohol reagiert und nicht mit einem Phenol.
Du könntest dein Produkt mal titrieren; zweimal die gleiche Menge, einmal mit Natriumhydrogencarbonat-Maßlösung, einmal mit Natronlauge (dabei aber vllt. besser eine Rücktitration). Wenn es sich um einen Ester handelt dürftest du eine Differenz im Verbrauch der beiden Lösungen bemerken.
Du könntest dein Produkt mal titrieren; zweimal die gleiche Menge, einmal mit Natriumhydrogencarbonat-Maßlösung, einmal mit Natronlauge (dabei aber vllt. besser eine Rücktitration). Wenn es sich um einen Ester handelt dürftest du eine Differenz im Verbrauch der beiden Lösungen bemerken.
"It is arguably true that the tetrapyrrole system is Nature's most remarkable creation."
- Claude Rimington
- Claude Rimington
... ob die Urtiter 'dort drüben' für den Halbmikromaßstab qualitativ dafür ausreichen?... 
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]