Einleitung:
In diesem Versuch möchte ich einmal zeigen wie allgegenwertig Hemmstoffe in der Natur vorkommen und wie man die nachweisen kann.
Geräte:
Bunsenbrenner bzw. Spiritusbrenner, Laborflaschen 100ml, Pinzette, Standzylinder, sterile Pipetten (1ml), Zellstofftücher, Handschuhe, Erlenmeyerkolben, Dampfdruck-Kochtopf bzw. Autoklav, sterile Petrischalen, Alufolie,
Testplättchen aus Cellulose, Wasserfester Stift
Chemikalien:
- LB-Agar oder CASO-Agar
- Wasserprobe aus einem Gewässer
-Sporensuspension von Bacillus subtilis min. 106-108 KBE/ml
(siehe Anreicherung und Isolierung von Bacillus subtilis)

Sicherheitshinweise:
Es gelten die allgemeinen Sicherheitshinweise für das Arbeiten im Labor und der Umgang mit Mikroorganismen.
Dieser Versuch sollte nur unter Beachtung der allgemeinen Sicherheitvorschriften durchgeführt werden. Ebenfalls erfordert
dieser Versuch ein gewisses Maß an Erfahrung und Verantwortung und sollte daher nur von erfahrenen Hobby-Mikrobiologen durchgeführt werden.
Durchführung:
Als erstes werden alle benötigten Materialien zurecht gelegt und alles gründlich desinfiziert. Es sollten nur Geräte und Materialien bereit gelegt werden, die auch für den Versuch benötigt werden.
Unnötiges Arbeitsmaterial birgt Kontaminationsquellen und sollte daher von der Arbeitsfläche beseitigt werden. Als ersten Schritt ist die Herstellung und das sterilisieren des Nährmediums anzusehen. Es
sollte nur soviel Nährmedium angesetzt werden, wie auch benötigt wird. Pro Petrischale benötigt man ca. 20 ml Nährboden. Ist der Sterilisationsprozess beendet, so wir der Nährboden aus dem Autoklaven, oder Dampdruckkochtopf entnommen und mit Alufolie verschlossen. Der Nährboden muss nun auf eine Temperatur von 60°C abkühlen und wird anschließend in den Platten ausgegossen. Dieser Arbeitschritt muss schnell und sorgfältig erfolgen. Der in den Schalen noch flüssige Agar wird pro Schale mit 1 ml der Sporensuspension beschickt und diese anschliesend durch kreisende Bewegung der Petrischale im Agar verteilt. Sind nun alle Nährböden gegossen und mit Bacillus subtilis beimpft, so lässt man diese erstarren und legt anschließend die sterilisierten Testplättchen auf den Agar auf. Ich empfehle pro Nährbodenplatte 4 Stück aufzulegen. Die Testplättchen dürfen nur mit der sterilisierten Pinzette aufgelegt werden. Jetzt werden die Testplättchen mit der Prüfsubstanz benetzt. Es empfiehlt sich, je nach Plättchengröße, ca. 200µl pro Plättchen aufzutragen. Die Beschriftung der Plättchen erfolgt mit Zahlen an der Unterseite der Petrischalen. Die Petrischalen werden umgedreht bei 36°C für 24h bebrütet und können dann ausgelesen werden. Sollten flüssige Proben verwendet werden, so stanzt man mit einem sterilen Korbohrer Löcher in den Nährboden und füllt die Probe hinein. Diese Platten dürfen nicht umgedreht werden.
Auswertung:
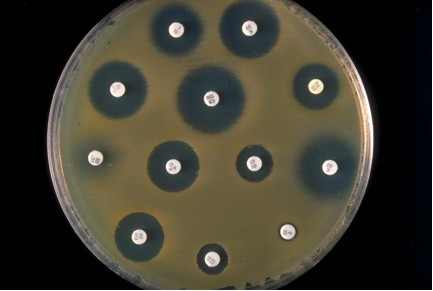
Schon nach einigen Stunden kann man beobachten, wie sich das Bacillus-Bakterium über den Nährboden verteilt. Sind jedoch in einer oder mehreren Proben Hemstoffe enthalten, so bilden sich um den Testplättchen Hemmhöfe.
Je nach Konzentration an Hemmstoffen fallen diese kleiner oder größer aus. Sind keine Hemstoffe vorhanden, so breiten sich die Bakterien über den gesamten Nährboden aus.
Erklärung:
folgt
Bilder


weitere Bilder folgen