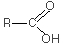
 --R'-OH-->
--R'-OH--> 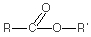 + H2O
+ H2OCarbonsäure + Alkanol --> Ester + Wasser
Nun gibt es die Thioessigsäure.
Kann man die Folgendermaßen herstellen?
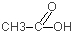 --H-SH-->
--H-SH--> 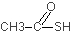 + H2O
+ H2OEthansäure + Schwefelwasserstoffgas --> Thioethansäure + Wasser
Moderator: Moderatoren
 --R'-OH-->
--R'-OH-->  + H2O
+ H2O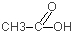 --H-SH-->
--H-SH--> 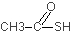 + H2O
+ H2OUnd die habe ich dir beantwortet: Mit Acetylchlorid und Natriumhydrogensulfid...Meine Hauptfrage war aber wie ich Thioessigsäure herstellen kann
Kommt drauf an wie du es machst...mit Benzoylchlorid wohl eher nicht, ansonsten vllt. schon, zumindest wenn du die Benzoesäure trocken erhitzt, sonst auch eher unwahrscheinlich. Warum?Kann bei der Synthese von Benzoesäureestern, Benzol entstehen?
Trockenes Erhitzen von Benzoaten. Trockenes Erhitzen von Benzoesäure. Cyclisierung von Ethin. Trockenes Erhitzen von Kohle. Reduktion von Benzendiazoniumsalzen. Erhitzen von Terephthalaten. Hydrolyse von Benzenmagnesiumhalogeniden. Hydrolyse von Benzolsulfonsäuren. Hydrolyse von Phenyllithium. Hydrolyse von Phenylnatrium. ... Genug?Bei welchen Reaktionen kann Benzol entstehen?
S. oben: "Trockenes Erhitzen von Benzoaten." btw, die Anleitung dort ist ursprünglich von uns.Auf chemshop gibts ne Anleitung mit Calciumhydroxid.... ist das bei allen hydroxiden so?