Das Antimon ist eines der ganz wenigen chemischen Elemente (im heutigen Sinne), die nach dem Ende des klassischen Altertums und vor dem Aufkommen der modernen Chemie isoliert wurden (siehe hier). Zu Beginn der Neuzeit führte Philippus Theophrastus Aureolus Bombastus von Hohenheim – besser bekannt als Paracelsus (1493 – 1541) - das bis dato allenfalls als Augenschminke (Kajal) verwendete Mineral Spießglanz als Arzneimittel ein. Paracelsus verstand die Alchemie als eine der Grundlagen der Heilkunde. Er lehrte, daß in jedem Körper ein "innerer Alchemist“, der "Archaeus“ wohne, der von den aufgenommenen Nahrungsmitteln, der Luft und dem Wasser das nützliche vom Unnützen scheide und für den Körper verwerte (womit er die moderne Idee des Stoffwechsels vorwegnahm). Im gleichen Sinne sollte der Arzt als „Iatrochemiker“ durch Laboratoriumsprozesse die natürlich gegebenen Heilmittel läutern, indem er "das Falsche vom Richtigen scheide“. Die auf Paracelsus zurückgehende Richtung der Alchemie wird daher auch Spargyrik (zusammengesetzt aus den griechischen Wörtern für "lösen“ und "verbinden“) genannt. Auf Paracelsus geht die Verarbeitung des Minerals Grauspießglanz zu weiteren Präparaten zurück, die medizinisch verwendet wurden.
Im Jahre 1604 erschien ein später berühmtes Buch, der "Triumph-wagen Antimonii", von dem Jenaer Stadtkämmerer Johann Tölde (1565–1624) unter dem Pseudonym "Basilius Valentinus" veröffentlicht, das die Chemie der Antimonverbindungen recht genau beschrieb und diese in den höchsten Tönen als Heilmittel pries.

Und schließlich entdeckte 1631 der Arzt und Alchemist Adrian von Mynsicht (1588 – 1638) , ein Anhänger der Lehren von Paracelsus, daß sich aus Weinstein und Spießglanzdestillat eine Substanz kristallisieren ließ, die eine in der damaligen Medizin hoch geschätzte Eigenschaft besaß: sie bewirkt Erbrechen. Der Brechweinstein, wie er bald genannt wurde, fand sich bis 1969 im deutschen Arzneibuch, als er mit dem Erscheinen der 7. Ausgabe desselben endgültig für obsolet erklärt wurde.
Hier beschreibe ich die Darstellung von Brechweinstein aus Grauspießglanz. Das Vorgehen folgt dabei den Vorschriften der Pharmakopöen und Präparatebücher des 19. Jahrhunderts, insbesondere der Pharmacopoea borussica. Um den historischen Kontext zu wahren, werde ich begleitend aus den unvergleichlich praxisnahen und detailgetreuen Kommentaren zur Pharmakopoe von Friedrich Mohr (1806-1879), der auch eine feine Ironie beherrschte, zitieren.
Material/Geräte:
500 ml-Rundkolben, durchbohrte Stopfen, Gasableitungsrohre, Schlauchverbindungen, Waschflasche, Gasbrenner, Dreifuß mit Drahtnetz, Stative, Destillationsapparatur mit Liebigkühler, Retorte 250 ml, Thermometer 360 °C, Kleine Kolben 100 und 50 ml, diverse Bechergläser 250, 500 und 1000 ml, Nutsche, Reibschale, Waage, Glasstäbe, Reagenzgläser, Meßzylinder, Bürette
Chemikalien:
Antimon-III-sulfid (geschlämmter Grauspießglanz)


Salzsäure 32 %


Natriumcarbonat

Kaliumhydrogentartrat
Natronlauge 1N

Thioacetamid


Salpetersäure 25 %

Silbernitrat



Kaliumhexacyanoferrat-II
Antimon-III-chlorid



Antimon-III-oxid


Kaliumantimonyltartrat


Sicherheitshinweise:
Beim Lösen des Antimonsulfids in Salzsäure wird reichlich Schwefelwasserstoff frei. Auch wenn man die unten beschriebenen Vorsichtsmaßregeln befolgt, sollte unter einem Abzug gearbeitet werden!
Versuchsdurchführung:
1. Antimon-III-chlorid aus Antimon-III-sulfid
Als Ausgangsmaterial dient geschlämmter Spießglanz, oder käufliches Antimon-III-sulfid (was vermutlich aber auch nichts anderes ist als gemahlener Spießglanz - meines enthielt jedenfalls erkleckliche Mengen Eisen). Um den bei der Reaktion entstehenden Schwefelwasserstoff zu entsorgen, empfiehlt Mohr, " … steckt man einen Kork mit einer langen Glasröhre auf den Kolben um die Gase 3 bis 4 Fuss über der Arbeitshöhe zu entlassen. Die Pharmacopoe empfiehlt dies im Freien zu thun. Die Gehöfte in Städten sind häufig sehr enge und die Bewohner werden von den Gasen immer belästigt. Es ist deshalb immer besser, ins Kamin abzuleiten, wodurch die Gase über den Dächern entleert werden.“
In Analogie dazu wurde folgender Versuchsaufbau verwendet:

In dem 500 ml-Rundkolben (links) übergießt man 25 g Antimon-III-sulfid mit 120 ml konzentrierter Salzsäure von 32 %. Die Reaktion setzt spontan ein, und wird nach einigen Minuten, wenn sie nachlässt, durch Erwärmen unterstützt. Der gebildete Schwefelwasserstoff passiert eine mit wenig Wasser gefüllte Sicherheitswaschflasche und wird dann in eine alkalische Lösung eingeleitet, wo er absorbiert wird. Dazu kann man verdünnte (etwa 5 %ige) Natronlauge verwenden, von der 500 ml in einem großen Kolben vorgelegt werden. Aus dem Absorptionsgefäß führt ein Ableitungsschlauch ins Freie. Es entweicht jedoch praktisch kein Schwefelwasserstoff und wenn man die Apparatur nicht vor Ende des Versuches öffnet, findet so gut wie gar keine Geruchsbelästigung statt.
Nach etwa 15 Minuten bemerkt man, daß sich das Wasser in der Waschflasche opaleszierend trübt. Nach etwa ½ Stunde hört die Gasentwicklung auf. Da noch ungelöste Reste des Minerals im Kolben vorhanden waren, wurden bei dem hier dokumentierten Versuch noch zweimal je 20 ml Salzsäure zugegeben (dazu musste ich den Kolben öffnen, was ich bereut habe!), jedoch nur mit geringem Effekt. Es blieb ein ungelöster Rückstand. Die entstehende Lösung ist braungelb gefärbt, was auf eine Verunreinigung mit Eisen zurückzuführen ist. Ein paar Tropfen geben in verdünnter Salzsäure mit Kaliumhexacyanoferrat eine kräftige Blaufärbung.


Man lässt die Flüssigkeit über Nacht absitzen und gießt vom Bodensatz klar ab. Dann wird sie durch Destillation eingeengt.

Über dem Gasbrenner kommt die Lösung (ca. 150 ml) nach wenigen Minuten ins Sieden. Zunächst geht gasförmiger Chlorwasserstoff über, der in der Sicherheitswaschflasche ganz rechts in den vorgelegten 50 ml Wasser absorbiert wird. Dabei beobachtet man, daß nicht etwa Gasblasen durch das Wasser perlen, sondern umgekehrt, durch die Absorption des Chlorwasserstoffs und den entstehenden Unterdruck, Luft durch die Waschflasche eingesaugt wird. Die besondere Konstruktion der Sicherheitswaschflasche verhindert ein Zurücksteigen des Waschwassers in die Vorlage. Nach 10 Minuten erreicht die Temperatur vor dem Kühler 108 °C und eine farblose Flüssigkeit beginnt überzudestillieren. Während der nächsten halben Stunde steigt die Temperatur nur gering auf 110 °C, an welchem Punkt die Vorlage gewechselt wird. Das erste Destillat - im Folgenden als Vorlauf 1 bezeichnet - betrug hier 120 ml. Anschließend steigt die Siedetemperatur rasch und erreicht nach 5 Minuten 120 °C, worauf die Destillation abgebrochen wird. In dieser Zeit waren bei mir 20 ml Vorlauf 2 überdestilliert. Im Kolben bleiben wenige Milliliter einer tiefbrauen, sirupösen Flüssigkeit zurück.

Zunächst wurde das spezifische Gewicht und den Salzsäuregehalt der übergegangenen Destillate bestimmt, letzteres durch Titration mit 1 N Natronlauge gegen Phenolphtalein. Ich habe bei meinem Versuch folgende Ergebnisse erhalten:
Vorlauf 1 (ca. 120 ml): Dichte 1,12 g/cm3 - 23,8 Gewichtsprozent HCl
Vorlauf 2 (ca. 20 ml): Dichte 1,138 g/cm3 - 22,4 Gewichtsprozent HCl
Die Dichte von Vorlauf 1 entspricht exakt seinem Gehalt an Salzsäure. Eine 22,4 %ige Salzsäure (Vorlauf 2) sollte aber nur eine Dichte von 1,11 g/cm3 besitzen. Die Differenz zum gemessenen Wert (ca. 3 g/100 ml) muss daher durch mit überdestilliertes Antimon-III-chlorid bedingt sein. Tatsächlich gibt der Vorlauf 2 in destilliertes Wasser eingetropft einen dichten weißen Niederschlag, der Vorlauf 1 dagegen nicht:

Ganz frei von Antimon ist aber auch der Vorlauf 1 nicht. Wenn man die Verdünnung mit einer Spatelspitze Thioacetamid erhitzt, scheidet sich orangegelbes Antimon-III-sulfid aus:
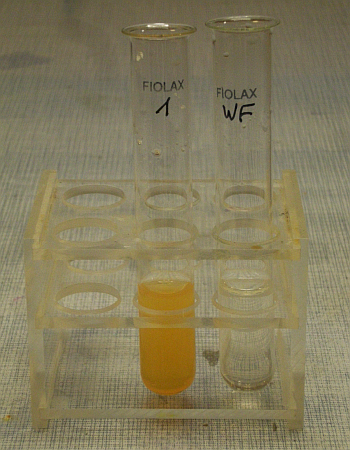
Das Wasser aus der Waschflasche enthielt 5% HCl und reagierte beim Erhitzen mit Thioacetamid negativ.
Der braungelbe Destillationsrückstand wird schließlich aus einer Retorte erneut destilliert. Dazu wird er umgegossen und der Kolben mit ein paar Tropfen des Vorlaufs 2 nachgewaschen. Einem Rat Mohrs folgend gibt man, um Siedeverzüge zu verhindern, einige Glaskugeln in die Retorte. Als Vorlage dient ein kleiner Kolben, der in einer halb mit Wasser gefüllten Schale liegt.

Der Hals der Retorte wird nicht gekühlt. Diese Destillation geht sehr schnell vor sich. Nach wenig mehr als einer Minute kommt die Flüssigkeit ins Sieden und die Temperatur steigt rasch an. Nach knapp 5 Minuten zeigt das Thermometer 220 °C an und die Vorlage wird gewechselt (Vorlauf 3). Es gehen farblose Tropfen über, bis in der Retorte nur noch ein trockener, rostfarbener Rückstand verbleibt. Das Präparat erstarrt zu einer diskret gelblich gefärbten Kristallmasse.

Man schmilzt das Antimontrichlorid durch vorsichtiges Erwärmen des Kolbens über einer Gasflamme und gießt in ein Präparategläschen um – dabei raucht die Substanz an der Luft deutlich – wo es erneut erstarrt.


In den Worten von Friedrich Mohr liest sich dieser Teil des Versuchs so:
“Man destilliert auf lebhaftem Feuer und fängt die ersten Mengen, die nicht erstarren und viel Salzsäure enthalten, besonders auf. Erst wenn die Flüssigkeiten schon im Hals der Retorte zu erstarren anfangen [dazu kam es bei meinem Versuch nicht], fängt man in einem reinen, trockenen Glase auf. Wenn das Feuer nicht zu stark ist, bedarf die Vorlage gar keiner Abkühlung. Das reine, wasserleere Chlorantimon destilliert in farblosen Tropfen über. Es erstarrt in der Kälte zu einer ganz trockenen, strahlig blättrig krystallinischen Masse unter bedeutender Contraction, so dass es in der Mitte stark eingesunken erscheint. Es ist ein sehr schönes Präparat."
Die Ausbeute (im tarierten Glas gewogen) betrug 17,7 g, das sind fast genau 50% vom Antimon-III-sulfid.
2. Antimon-III-oxid aus Antimon-III-chlorid
Man löst 10 g Antimon-III-chlorid in 10 Teilen Salzsäure von 20 % auf und fällt die klare Lösung wie unten beschrieben. Ich habe auch die vereinigten Vorläufe 2 und 3, die ja größere Mengen Antimontrichlorid enthielten, auf diese Weise verarbeitet. Zuvor hatte ich sie mit der Bettendorf’schen Probe auf Abwesenheit von Arsen geprüft.
In einem großen Becherglas werden 800 ml Wasser bis fast zum Sieden erhitzt und die salzsaure Antimontrichloridlösung eingegossen. Es scheidet sich ein flockiger weißer Niederschlag ab, der in der Alchemie Algaroth genannt wurde:

Der Niederschlag setzt sich rasch, da er ziemlich voluminös ist aber nicht vollständig, ab. Die überstehende Flüssigkeit wird abgegossen, das Algaroth über eine Nutsche abgesaugt, und der erhaltene breiige Rückstand in 200 ml heißer Sodalösung (5 g Natriumcarbonat in 200 ml Wasser) resuspendiert. Die Mischung wird bis zum Sieden erhitzt. Sehr bald beobachtet man eine Veränderung des Niederschlages: er wird feiner, schwerer und setzt sich jetzt beim Stehenlassen rasch vollständig ab.

Nach dem Abnutschen wird portionsweise mit insgesamt 400 ml heißem Wasser nachgewaschen, abgeklatscht und auf einem Uhrglas getrocknet.

Aus meinen Vorläufen habe ich 3,2 g Antimon-III-oxid erhalten, was nochmals 15% des eingesetzten Antimonsulfids entspricht. Im Ganzen betrug die Ausbeute bei der Verarbeitung des Spießglanzes also rund 2/3. Um zu prüfen, ob auch wirklich kein Chlorid mehr vorhanden ist, wird eine Reagenzglasrundung des Präparates mit 2 Tropfen Natronlauge (1 N) und 3 ml Wasser aufgekocht, filtriert und das Filtrat mit Salpetersäure und Silbernitratlösung versetzt. Bei meinem Produkt trat keinerlei Trübung auf.
3. Darstellung von Kaliumantimonyltartrat (Brechweinstein)
Die Originalvorschrift der Pharmacopoea borussica editio septima lautet:

Es werden 100 ml Wasser zum Sieden erhitzt und 10 g Kaliumhydrogentartrat sowie 8 g Antimon-III-oxid eingetragen. Die anfangs stark trübe Mischung wird allmählich klarer und nach 15-minütigem Kochen ist nur noch ein geringer Bodensatz vorhanden. Man filtriert durch ein Faltenfilter und einen mit heißem Wasser ausgespülten Trichter in eine Kristallisierschale und lässt abkühlen, wobei man die Schale zuletzt über Nacht in den Kühlschrank stellt:

Erhalten wurden 11 g Kaliumantimonyltartrat in klaren, glitzernden Kristallen (Ausbeute 62 %).

Die überbleibende, gesättigte Lösung kann man noch etwas eindampfen, um weitere Mengen Brechweinstein zu gewinnen. Die letzte Mutterlauge wird erhitzt und mit Ammoniaklösung versetzt, wodurch das Antimon wieder als Antimon-III-oxid gefällt und zurückgewonnen wird.
Entsorgung:
Reste der Lösungen sowie nicht mehr benötigte Präparate werden zu den Schwermetallabfällen gegeben.
Erklärungen:
Obwohl das Antimon dem Arsen, unter dem es in der fünften Hauptgruppe des Periodensystems steht, chemisch in vieler Hinsicht ähnlich ist, bestehen zwischen den beiden Elementen doch bedeutsame Unterschiede. Im Allgemeinen kann man sagen, daß sich das Antimon viel mehr wie ein Metall verhält, als das Arsen.
Das natürlich vorkommende Antimon-III-sulfid – das Mineral Grauspießglanz – ist selten rein. Die häufigsten Begleiter des Antimons im Grauspießglanz sind Eisen, Blei und Arsen. Diese werden bei der Darstellung der Präparate sukzessive abgetrennt. Zunächst wird das Antimon-III-sulfid in konzentrierter Salzsäure unter Bildung von Antimon-III-chlorid aufgelöst:
Sb2S3 + 3 HCl ---> SbCl3 + 3 H2S
Etwa vorhandenes Blei fällt als Bleichlorid aus und wird durch das Dekantieren der salzsauren Lösung entfernt, die dann der fraktionierten Destillation unterworfen wird.
Aus dem stark salzsauren Gemisch geht zunächst gasförmiger Chlorwasserstoff und dann eine wässrige Lösung desselben über. Man würde zunächst das bei 109°C siedende Azeotrop der Salzsäure, das 20,2 Masse-% HCl enthält, erwarten, wofür auch spräche, daß die beobachtete Siedetemperatur sich über eine geraume Zeit in diesem Bereich hält. Die Analyse zeigt aber, daß eine höher konzentrierte Salzsäure übergeht - vermutlich, weil eben keine reine Salzsäure, sondern ein stark Antimontrichlorid-haltiges Gemisch vorgelegt wurde.
Wenn das Ausgangsmaterial Arsen enthielt, liegt dieses in der salzsauren Lösung als Arsen-III-chlorid vor. Arsen-III-chlorid ist bedeutend flüchtiger (Siedepunkt 130 °C) als die entsprechende Antimonverbindung und geht daher bei der Destillation wesentlich früher als dieses über. Da die die Bettendorff´sche Probe des Vorlaufs 2 und 3 (wie auch im Ausgangsmaterial) negativ ausfiel, war der von mir eingesetzte Spießglanz offenbar doch weitestgehend frei von Arsen.
Oberhalb von 220 °C destilliert das reine Antimontrichlorid. Eisen bleibt als Eisen-III-chlorid im Rückstand in der Retorte zurück. Die diskret gelbliche Färbung meines Destillates lässt zwar vermuten, daß doch Spuren von Eisen mit übergegangen waren, offenbar aber nicht so viel, daß die Berliner-Blau-Reaktion angeschlagen hätte. Das Präparat ist in Reinform kristallinisch fest. Antimon-III-chlorid schmilzt bei 73 °C und siedet bei 223 °C. Die in dem älteren Büchern beschriebene, weiche Konsistenz (Butyrum antimonii – “Antimonbutter“) entsteht wahrscheinlich, wenn es noch freie Salzsäure enthält.
Das Antimon-III-chlorid ist in wässriger Lösung nur bei Anwesenheit von reichlich Salzsäure beständig. Beim Verdünnen der Lösung mit Wasser hydrolysiert es und es fällt Antimonoxichlorid (Algaroth) aus:
SbCl3 + H2O ---> SbOCl + 2 HCl
Hierin ähnelt das Antimon bereits stark dem in der gleichen Gruppe unter ihm stehenden Bismut, das ebenfalls gerne Oxisalze bildet. Dagegen setzt sich Arsentrichlorid mit Wasser zu Arseniger Säure (As2O3) um. Algarothpulver wird durch Erhitzen mit Natriumcarbonatlösung in Antimon-III-oxid umgewandelt:
2 SbOCl + Na2CO3 ---> Sb2O3 + 2 NaCl + CO2
Natürlich könnte man die Antimontrichloridlösung auch gleich in Sodalösung eingießen, wobei aber eine heftige Kohlendioxidentwicklung und starkes Aufschäumen zu erwarten wäre. Antimontrioxid ist in Natriumcarbonat – im Gegensatz zu Arsentrioxid – nicht löslich. Letzteres bildet unter diesen Bedingungen Natriumarsenit:
As2O3 + Na2CO3 ---> 2 NaAsO2 + CO2
Beim anschließenden Auswaschen wird das leicht wasserlösliche Natriumarsenit entfernt, wodurch eine weitere Trennung des Antimons von eventuell begleitendem Arsen erreicht wird.
Schließlich bildet sich beim Kochen von Antimon-III-oxid mit Kaliumhydrogentartrat (Weinstein, lateinisch Tartarus) eine Komplexverbindung, das Kaliumantimonyltartrat:
Sb2O3 + 2 KH(C4H4O6) ---> K2Sb2C8H4O12 + 3 H2O
Dieses Salz, der berühmte Brechweinstein, löst sich in kaltem Wasser nur mäßig (ca. 5,5 g/100 ml), in siedendem Wasser aber recht gut (ca. 33 g/100 ml) und lässt sich daher durch Kristallisieren leicht rein erhalten.
Die Formel des Kaliumantimonyltartrates wird in der älteren Literatur anders angegeben als heute:
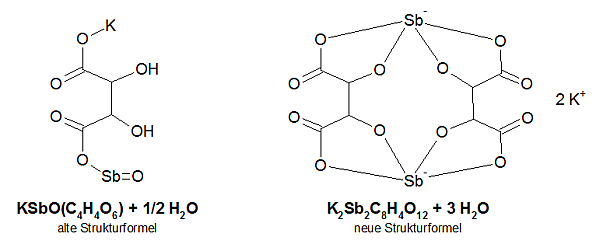
Es ist offensichtlich, daß die Konstitution des Komplexes erst in neuerer Zeit korrekt aufgeklärt wurde. Aber die Summenformeln sind im Grunde identisch, indem die zweite pro K und Sb zwei H und ein O weniger enthält, was andererseits als Kristallwasser wieder zugeschlagen wird. Auch die Molmasse beträgt nach der „neuen“ Formel (667,85 g/mol) genau das Doppelte der „alten“ Formel (333,9 g/mol), wenn man das Kristallwasser mit einbezieht.
In Wasser hydrolysiert das Kaliumantimonyltartrat, weshalb seine Lösung sauer reagiert:

Nachwort: Antimon in der Medizin
Das Kaliumantimonyltartrat wurde in der Pharmazie als Tartarus emeticus oder, weniger qualitativ und chemisch etwas genauer, als Tartarus stibiatus bezeichnet

(Standgefäß aus den 50er Jahren des letzten Jahrhunderts)
Zur Anwendung schrieb der Pharmakologe Hermann von Tappeiner (1847-1927) noch in der 1922 erschienen Auflage seines Lehrbuches der Arzneimittellehre:
“Als Brechmittel ist der Brechweinstein nur bei kräftigen, erwachsenen Personen räthlich wegen der starken vorangehenden Nausea und der nachträglichen, von Appetitlosigkeit, manchmal auch von Durchfällen begleiteten Erschöpfung. Die nach 5-10 Minuten wirkende Dosis ist 0,1, als Pulver oder Lösung verabreicht. … Als Expectorans wird Brechweinstein gebraucht zu 0,005 - 0,01 in Lösung mehrmals täglich.“
Unter einem Expectorans verstand man ein Mittel, das die Entfernung von Schleim aus den Atemwegen erleichtern sollte. Die durch das Kaliumantimonyltartrat hervorgerufene Übelkeit ist von einer starken Sekretabsonderung der Schleimhäute (oft auch von Schwitzen) begleitet, was man als erwünschte “schleimlösende“ Wirkung ansah. Die Dosen sind als Gramme zu lesen, die Angabe “0,005“ bezeichnet somit 5 mg. Demgegenüber hatte Mohr schon 1863 im Kommentar zur preußischen Pharmakopöe die Verwendung von Brechweinstein als Arzneimittel scharfzüngig kritisiert:
“Im Laufe der Zeit hat der Currus triumphalis antimonii viel von seinem Glanze verloren und ein Präparat nach dem anderen ist ausgemerzt worden. … Wir sind an der Zeit, die Frage aufzuwerfen, ob irgend ein Antimonpräparat noch in den Arzneischatz gehört, ob jemals mit einem Antimonpräparat geheilt worden ist, und ob nicht in allen Fällen die Antimonpräparate sich als überflüssig oder sogar schädlich bewiesen haben. Schrei des Entsetzens ringsumher. Gleichwohl gehen wir ruhig auf die Sache ein. Es ist bekannt, daß alle Antimonpräparate … in kleinerer Menge Übelkeit und Brechen erregen, dass sie aber in größeren Mengen eingebracht als Gifte wirken und den Tod nach sich ziehen. Wer jemals ein tüchtiges Antimonbrechmittel mit etwa 3 Gran [rund 180 mg] Tartarus emeticus genommen hat, wird sich wohl noch des furchtbaren Zustandes erinnern, den ihm dieses Gift im Leibe veranlasste. Übelkeit, Brechen, Würgen, Abführen, Wadenkrampf zu gleicher Zeit ist zu viel für einmal. Es ist der höchste Zustand menschlichen körperlichen Elends, den man erregen kann.“
Nach dieser eindringlichen Schilderung darf man annehmen, daß Mohr selbst die Wirkungen des Brechweinsteins am eigenen Leibe erlebt hatte. Anschließend berichtet er über mehrere Fälle tödlicher Vergiftungen und schließt mit den Worten:
“Bei all diesem Material kommt er [Taylor, ein englischer Arzt, den Mohr zitiert] doch nicht zu dem Schlusse, dass das Antimon als inneres Heilmittel ganz zu verwerfen sei, daß es nicht nur überflüssig, sondern sogar schädlich ist. So groß ist die Macht des Vorurteils und der Gewohnheit. Man will mit Brechweinstein in gebrochener Dosis Uebelkeit erregen, welcher Wahnsinn! Wenn man Uebelkeit hätte, so würde man sie zu heilen suchen. Uebelkeit ist ein Zustand von Unwohlbefinden, den man dadurch zu beseitigen sollte, daß man die Ursache entfernte. … Es geht demnach das gewiss befremdliche Resultat aus dieser Darstellung hervor, daß der Brechweinstein und alle Antimonpräparate zum inneren Gebrauch nicht nur entbehrlich, sondern sogar schädlich sind.“
Wie groß die von Mohr kritisierte Macht des Vorurteils und der Gewohnheit ist, zeigt ein aktueller Fall, der 2012 in der Fachzeitschrift „New England Journal of Medicine“ veröffentlicht wurde. Eine Frau verabreichte ihrem Ehemann Brechweinstein in Orangensaft, mit der Absicht, ihn von seinem Alkoholabusus zu kurieren. Diese Anwendung wird schon von Tappeiner in seiner Arzneimittellehre von 1922 als obsolet berichtet:
“Die Anwendung der Brechmittel war früher viel häufiger und mannigfaltiger als jetzt … Durch sogenannte Ekelkuren suchte man Gewohnheitstrinkern den Genuss des Weines oder Fettleibigen die Tafelfreuden zu verleiden“
Der vergiftete Ehemann überlebte die „Kur“ unter intensivmedizinischer Behandlung mit Dialyse, Chelatbildnern und aggressiver Kreislaufunterstützung. Da bereits nach Dosen zwischen 200 und 1000 mg Brechweinstein tödliche Vergiftungen vorkommen, ist es unverständlich, warum die Substanz in der EU-Gefahrstoffkennzeichnung nur als "Gesundheitsschädlich“ eingestuft ist. Heute ist nur noch eine einzige Antimonverbindung in medizinischem Gebrauch. Es handelt sich um das Natriumstibogluconat-V, eine dem Brechweinstein strukturell verwandte Komplexverbindung, die das Antimon jedoch in fünfwertiger Form enthält.
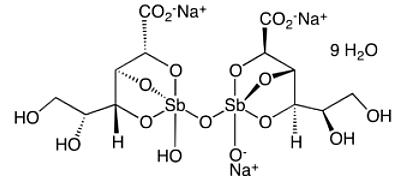
Fünfwertige Antimonverbindungen sind (was übrigens auch für die Arsenverbindungen gilt) weniger toxisch als dreiwertige. Natriumstibogluconat ist zur Behandlung der Leishmaniose, einer durch Protozoen hervorgerufenen Tropenkrankheit, noch immer ein Mittel der ersten Wahl und wird in einer Dosis von 10-20 mg Sb/kg Körpergewicht täglich i.m. verabreicht. In den letzten Jahren werden jedoch auch für diese Indikation zunehmend andere Präparate entwickelt.
Literatur:
Basilius Valentinus: Triumph-Wagen des Antimonii mit Theodori Kerckringii Anmerckungen nebst einem Vorbericht ...; Neue Auflage, Nürnberg 1752, Adam Jonathan Felseckers Erben
Deutsches Arzneibuch, 6. Ausgabe, Neudruck 1951
Karl Friedrich Mohr: Kommentar zur preussischen Pharmakopöe nebst Übersetzung des Textes, Dritte umgearbeitete Auflage nach der siebten Auflage der Pharmacopoea Borussica; Braunschweig, Verlag von Friedrich Vieweg und Sohn 1863
Reinhardt Blochmann: Anleitung zur Darstellung chemischer anorganischer Präparate für Chemiker und Pharmazeuten; Leipzig, Verlag von Veit &Comp. 1895
Emil Knoevenagel: Praktikum des Anorganischen Chemikers, zweite Auflage; Leipzig, Verlag von Veit &Comp. 1909
Küster/Thiel: Rechentafeln für die chemische Analytik, 102. Auflage; Walter de Gruyter Berlin – New York 1982, ISBN 3-11-006653-X
Jander-Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie; 15. Auflage 2002 Verlag S.Hirzel, Stuttgart, ISBN 3-7776-1146-8
H. v. Tappeiner: Lehrbuch der Arzneimittellehre und Arzneiverodnunglehre, 15. Neu bearbeitete Auflage; Leipzig, Verlag von F.C.W. Vogel 1922
Konstantopoulos WM et al: A 34-Year-Old Man with Intractable Vomiting after Ingestion of an Unknown Substance; NEJM 367 (3) 2012: 259-268
