Spiritus + Glühdraht
Moderatoren: Moderatoren, Assistenten
-
CD-ROM-LAUFWERK
- Illumina-Mitglied
- Beiträge: 581
- Registriert: Sonntag 5. Januar 2014, 23:05
- eule
- Illumina-Mitglied
- Beiträge: 822
- Registriert: Mittwoch 8. Januar 2014, 00:37
- Wohnort: europa
- Kontaktdaten:
wenn das wirklich essigsäure ist, dann wäre der fruchtige geruch wohl nicht adehyd sondern evtl essigäther
Unendliche Vielfalt in unendlicher Kombination.
Agressiv und feindselig, boshaft, manipulierend und hinterhältig, hämisch, überkritisch, herrschsüchtig und sinnlos brutal, das sind die Primärtugenden, die zusammengenommen Menschen vor allen anderen Spezies auszeichnen.
Agressiv und feindselig, boshaft, manipulierend und hinterhältig, hämisch, überkritisch, herrschsüchtig und sinnlos brutal, das sind die Primärtugenden, die zusammengenommen Menschen vor allen anderen Spezies auszeichnen.
-
Glaskocher
- Illumina-Mitglied
- Beiträge: 2534
- Registriert: Dienstag 27. Oktober 2015, 22:17
- Wohnort: Leverkusen
Ich sehe es ähnlich wie @NI2. Wenn man in eine Pasteurpipette etwas Metallwolle steckt, dann ist ein Flammrückschlag nahezu ausgeschlossen. Mit einer Eisenwollfüllung arbeite ich, wenn ich aus CaC2 Ethin darstelle und das Gas zur Demonstration der hellen Flamme und der starken Rußbildung entzünde. Ich weiß um den Rums von derartigen Explosionen und fühle mich sicher mit dieser Konstruktion, da ich die Grenzspaltweite sicher unterschritten habe. Wenn man das Röhrchen knapp neben der Flamme platziert, dann bläst ein Luftstrom die Flamme nicht aus und das Gas wird trotzdem sicher gezündet.### Hat jemand Erfahrung mit dem laufenden Abfackeln von solchen brennbaren Gasströmen? Einfach ein spitzes Glasrohr kurz vor einem Teelicht enden lassen? Und dieses anzünden, sobald der Sauerstoff aus der Apparatur verdrängt ist? Sonstige Ideen, überschüssiges Gas loszuwerden?
-
Reosir
- Illumina-Mitglied
- Beiträge: 156
- Registriert: Samstag 23. Juni 2018, 11:13
- Wohnort: Süddeutschland
Vorab schon mal eine Frage aus der Tiefe des Texts:
### Würde bitte jemand zweites auch mal unter http://www.uv-vis-spectral-atlas-mainz.org/ schauen, ob man die Spektren hier wirklich frei verwenden kann?
 'Bei 287 nm ist eine Bande, die gut mit dem Literaturwert für Acetaldehyd (290 nm in Heptan, "Organische Chemie" von Allinger) übereinstimmt.'
'Bei 287 nm ist eine Bande, die gut mit dem Literaturwert für Acetaldehyd (290 nm in Heptan, "Organische Chemie" von Allinger) übereinstimmt.'
Habe gestern eine sehr schöne Zusammenstellung von Gasphasen-Elektronenspektren gefunden: http://www.uv-vis-spectral-atlas-mainz.org/
So macht das Spektrometer gleich doppelt so viel Spaß
So weit ich das sehe, müsste man die Spektren aus dem "Spectral Atlas" hier als Bild einfügen dürfen, wenn man die Quelle angibt:
Bloß die Angabe in Absorptionsquerschnitten ist etwas gewöhnungsbedürftig:
wobei c die Stoffmengenkonzentration und NA die Avogadrokonstante sein soll, nachdem n schon als Teilchenkonzentration belegt war.
ln(I / I0) = - σ d c NA
ln(I0 / I) = σ d c NA
E = log (I0 / I) = ln (I0 / I) / ln(10) = σ d c NA | ln(10)
Damit ist der übliche Extinktionskoeffizient = σ * NA / ln(10)
in einer Einheit von cm² * 1 * mol⁻¹ = cm²/mol
und muss noch durch 1000 geteilt werden um die übliche Einheit cm²/mmol = l mol⁻¹ cm⁻¹ zu bekommen. D.h. letztlich muss man die Absorptionsquerschnitte nur mal
6,022*1023 / 1000 / ln(10) = 2,615*1020 nehmen um zu Extinktionskoeffizienten zu kommen. Bei Acetaldehyd kommt man damit bei den Literaturangaben gut hin.
Ein ideales Gas hätte ein Molvolumen von etwa 25 Litern und damit eine Konzentration von 40 mmol/l. Die zu erwartende Extinktion einer Reinsubstanz in der 1 cm-Küvette wäre also 4% des Werts des Extinktionskoeffizienten. Ein Bestandteil mit 1 Vol.-% hätte damit 0,4 mmol/l. Die zu erwartende Extinktion in der 1 cm-Küvette wäre also 0,04% des Werts des Extinktionskoeffizienten.

### Würde bitte jemand zweites auch mal unter http://www.uv-vis-spectral-atlas-mainz.org/ schauen, ob man die Spektren hier wirklich frei verwenden kann?
Deshalb habe ich das ja auch so vorsichtig formuliertmgritsch hat geschrieben:Also mit der UV/VIS Messung und dem raschen Schluss auf Acetaldehyd da habe ich noch merkliche Zweifel.
So arg viele Sachen finde ich da gar nicht. In der Gegend um 290 nm hat z.B. das "Organische Chemie" von Allinger nur Aldehyde, Ketone und Nitroalkane. Das "Practical HPLC Methode Development" von Snyder hat zwar Aldehyde, Azoverbindungen, Bromide, Jodide, Ketone, Salpetersäureester, Nitrosylverbindungen, vier konjugierte Doppelbindungen und konjugierte Alkenine gelistet. Davon machen bei der Ausgangslage aber nur Aldehyde, Ketone und konjugiertes Irgendwas Sinn.mgritsch hat geschrieben:Ich konnte auf die schnelle leider keine Vergleichsspektren auftreiben, aber in dem fraglichen Bereich absorbieren viele Stoffe in sehr ähnlichen Profilen. Du hast ziemlich sicher eine Mischung und da würde ich mir mal anschauen wie die einzelnen Spektren so aussehen.
Habe gestern eine sehr schöne Zusammenstellung von Gasphasen-Elektronenspektren gefunden: http://www.uv-vis-spectral-atlas-mainz.org/
So macht das Spektrometer gleich doppelt so viel Spaß
So weit ich das sehe, müsste man die Spektren aus dem "Spectral Atlas" hier als Bild einfügen dürfen, wenn man die Quelle angibt:
### Würde bitte jemand zweites auch mal unter http://www.uv-vis-spectral-atlas-mainz.org/ schauen, ob man die Spektren hier wirklich frei verwenden kann?MPI-Mainz UV/VIS spectral atlas hat geschrieben:When referring to the Spectral Atlas, please cite our publication:
Keller-Rudek, H., Moortgat, G. K., Sander, R., and Sörensen, R.: The MPI-Mainz UV/VIS spectral atlas of gaseous molecules of atmospheric interest, Earth Syst. Sci. Data, 5, 365–373, (2013), DOI: 10.5194/essd-5-365-2013
Bloß die Angabe in Absorptionsquerschnitten ist etwas gewöhnungsbedürftig:
Mit etwas umstellen und n = c * NA wird daraus I / I0 = e -σ d c NAMPI-Mainz UV/VIS spectral atlas hat geschrieben:The absorption cross section σ is defined by the Beer-Lambert law describing the attenuation of light by a homogeneous absorbing system:
I = I0 exp -(σ d n)
where I0 and I are the incident and transmitted light intensities, d is the absorption path length (in cm), n is the concentration of the absorber (in molecule/cm3), and σ is the absorption cross section (in cm2 molecule-1).
wobei c die Stoffmengenkonzentration und NA die Avogadrokonstante sein soll, nachdem n schon als Teilchenkonzentration belegt war.
ln(I / I0) = - σ d c NA
ln(I0 / I) = σ d c NA
E = log (I0 / I) = ln (I0 / I) / ln(10) = σ d c NA | ln(10)
Damit ist der übliche Extinktionskoeffizient = σ * NA / ln(10)
in einer Einheit von cm² * 1 * mol⁻¹ = cm²/mol
und muss noch durch 1000 geteilt werden um die übliche Einheit cm²/mmol = l mol⁻¹ cm⁻¹ zu bekommen. D.h. letztlich muss man die Absorptionsquerschnitte nur mal
6,022*1023 / 1000 / ln(10) = 2,615*1020 nehmen um zu Extinktionskoeffizienten zu kommen. Bei Acetaldehyd kommt man damit bei den Literaturangaben gut hin.
Ein ideales Gas hätte ein Molvolumen von etwa 25 Litern und damit eine Konzentration von 40 mmol/l. Die zu erwartende Extinktion einer Reinsubstanz in der 1 cm-Küvette wäre also 4% des Werts des Extinktionskoeffizienten. Ein Bestandteil mit 1 Vol.-% hätte damit 0,4 mmol/l. Die zu erwartende Extinktion in der 1 cm-Küvette wäre also 0,04% des Werts des Extinktionskoeffizienten.
Da muss ich erstmal Fuchsin und Sulfit bestellen. Und Silbernitrat habe ich auch keins mehr gefunden. Werde schon noch was bestellen, wenn ich anders nicht zum Ziel komme. Andererseits habe ich noch einen alten Formaldehyd-Schnelltest da, der auch auf andere Aldehyde anschlagen soll. Als erstes werde ich aber mal die Substanzen mit ähnlichen UV-Spektren hier einzeln durchgehen. Ich bin eben ein Spektroskopie-Fanmgritsch hat geschrieben:Bisher hast du keinen einzigen abgesicherten Beweis auf Aldehyd außer etwas Geruch. Fuchsinschwefligsäure kostet nur ein paar Minuten und mit etwas Glück/Verdünnung kannst du sogar eine grobe quantitative Abschätzung treffen aus der Farbintensität. Jetzt schon mit Absorption den Verlauf interpretieren erscheint mir gewagt.
So wie sich das liest denke ich schon. Das Paper ist unter Creative Commons Attribution 3.0 License als Namensnennung lizenziert und auf der Seite steht auch:Reosir hat geschrieben:Vorab schon mal eine Frage aus der Tiefe des Texts:
### Würde bitte jemand zweites auch mal unter http://www.uv-vis-spectral-atlas-mainz.org/ schauen, ob man die Spektren hier wirklich frei verwenden kann?
Im Zweifelsfalle nochmal anfragen, sitzen ja in Deutschland.When referring to the Spectral Atlas, please cite our publication:
Keller-Rudek, H., Moortgat, G. K., Sander, R., and Sörensen, R.: The MPI-Mainz UV/VIS spectral atlas of gaseous molecules of atmospheric interest, Earth Syst. Sci. Data, 5, 365–373, (2013), DOI: 10.5194/essd-5-365-2013
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
-
Reosir
- Illumina-Mitglied
- Beiträge: 156
- Registriert: Samstag 23. Juni 2018, 11:13
- Wohnort: Süddeutschland
Jo danke, mit Zweit- und Drittmeinung fühle ich mich schon etwas sicherer beim ZündelnGlaskocher hat geschrieben:Ich sehe es ähnlich wie @NI2. Wenn man in eine Pasteurpipette etwas Metallwolle steckt, dann ist ein Flammrückschlag nahezu ausgeschlossen.
Das hat bei der Pyrolyse+UV-Beschreibung noch gefehlt: Habe das Gas mittlerweile im Reagenzglas angezündet: Eine blaue Flammenfront hat sich mit ca. 5 cm/s ohne Ton reinwärts gebrannt. Passt also gut zu Ethylen - vielleicht mit etwas Luft als Verunreinigung.
-
Glaskocher
- Illumina-Mitglied
- Beiträge: 2534
- Registriert: Dienstag 27. Oktober 2015, 22:17
- Wohnort: Leverkusen
Das passt auf recht viele unterstöchiometrische Gemische von brennbaren Gasen mit Luft. Bei einem recht reinen Ethen hätte ich eine gelbe Flamme mit Rußbildung erwartet. Bei Ethanal und Ethanol würde das Ganze auch so erwartet. Bei Wasserstoff scheint typisch zu sein, daß die Flammfront "hüpft" und dadurch Geräusche erzeugt.Eine blaue Flammenfront hat sich mit ca. 5 cm/s ohne Ton reinwärts gebrannt.
Die Ursache des typischen "Pfeifgeräusches" einer übersättigten Knallgasprobe ist sicher auch ein interessantes Forschungsthema.
-
Reosir
- Illumina-Mitglied
- Beiträge: 156
- Registriert: Samstag 23. Juni 2018, 11:13
- Wohnort: Süddeutschland
Spiritus + Glühdraht mit UV-Spektrometer: Wasser
--> Wasser trägt zum Spektrum des Produktgemischs wohl nur im Bereich um 190 nm schwach bei. Für den Bereich 200 bis 290 nm fehlen allerdings Literaturwerte.
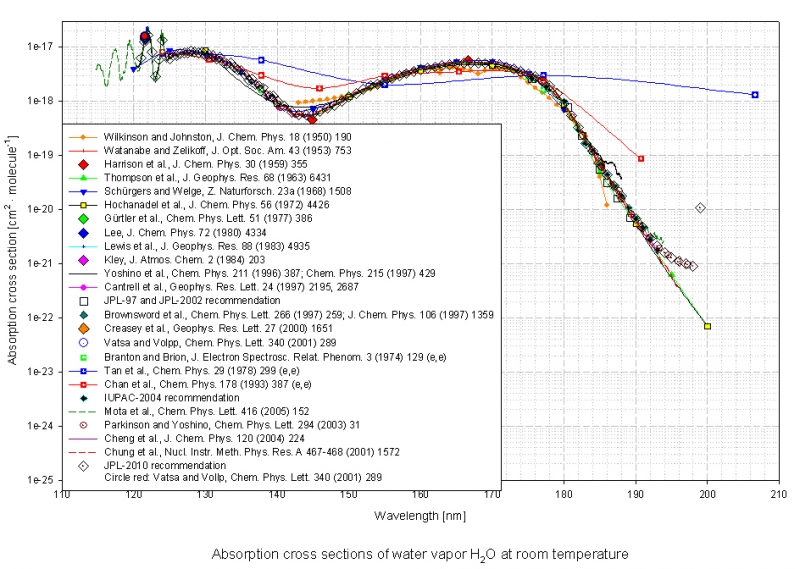
Quelle: Keller-Rudek, H. et al. - H2O_115-207nm_log.jpg von http://satellite.mpic.de/spectral_atlas ... er/H2O.spc
Im Bereich 290 - 420 nm, der wegen der Bande bei 287 nm besonders interessiert, gibt es ebenfalls nur extrem geringe Extinktionen von bis zu 3e-24 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,00003
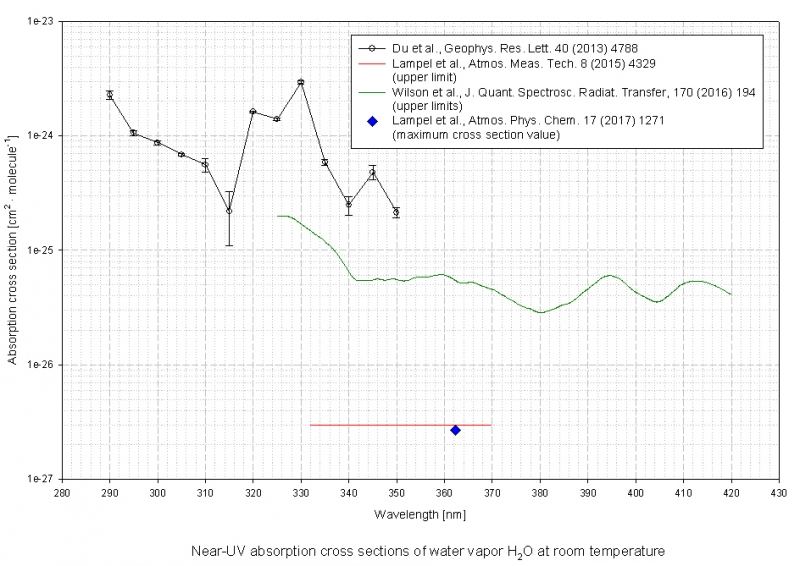
Quelle: Keller-Rudek, H. et al. - H2O_290-420nm_log.jpg von http://satellite.mpic.de/spectral_atlas ... er/H2O.spc
Für den Bereich von 200 bis 290 nm scheint es keine Absorptionsspektren für Wasserdampf zu geben. Sieht aus, als hätte die Klimaforschung nicht gerade ein besonders stabiles Fundament.
--> Wasser trägt zum Spektrum des Produktgemischs wohl nur im Bereich um 190 nm schwach bei. Für den Bereich 200 bis 290 nm fehlen allerdings die Messwerte.
Wasserdampf dürfte im ganzen Messbereich für Gasmessungen so gut wie transparent sein: Der Absorptionsquerschnitt von 6.72e-21 cm²/Molekül für 190 nm und noch kleiner für >190 nm entspräche einer Extinktion von etwa 6.72e-21 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,07 für blanken Wasserdampf bei 25 °C und 1 bar. (Einzelheiten zur Berechnung siehe https://illumina-chemie.org/spiritus--gl ... html#72038). Das wäre natürlich - kaum machbarer - massivst übersättigter Wasserdampf, denn an sich ist der Dampfdruck bei 25 °C nur 32 mbar ("Tabellenbuch Chemie" von Kaltofen). Gesättigter Wasserdampf hätte nur eine Extinktion von etwa 0,07 * 32 mbar / 1 bar = 0,002.mgritsch hat geschrieben:Du hast ziemlich sicher eine Mischung und da würde ich mir mal anschauen wie die einzelnen Spektren so aussehen. Wasser, Ethanol mal ganz vorne...

Quelle: Keller-Rudek, H. et al. - H2O_115-207nm_log.jpg von http://satellite.mpic.de/spectral_atlas ... er/H2O.spc
Im Bereich 290 - 420 nm, der wegen der Bande bei 287 nm besonders interessiert, gibt es ebenfalls nur extrem geringe Extinktionen von bis zu 3e-24 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,00003

Quelle: Keller-Rudek, H. et al. - H2O_290-420nm_log.jpg von http://satellite.mpic.de/spectral_atlas ... er/H2O.spc
Für den Bereich von 200 bis 290 nm scheint es keine Absorptionsspektren für Wasserdampf zu geben. Sieht aus, als hätte die Klimaforschung nicht gerade ein besonders stabiles Fundament.
--> Wasser trägt zum Spektrum des Produktgemischs wohl nur im Bereich um 190 nm schwach bei. Für den Bereich 200 bis 290 nm fehlen allerdings die Messwerte.
-
CD-ROM-LAUFWERK
- Illumina-Mitglied
- Beiträge: 581
- Registriert: Sonntag 5. Januar 2014, 23:05
Warum sollte sich das Klima für diesen Wellenlängenbereich (200 bis 290 nm) besonders interessieren?Sieht aus, als hätte die Klimaforschung nicht gerade ein besonders stabiles Fundament.
Ich habe mir hier gerade mal die "2000 ASTM Standard Extraterrestrial Spectrum Reference" runtergeladen.
Der Bereich unter 290nm integriert gibt 9,5W ggü. 1364W des kompletten "Weltraumspektrums", also 0.7%.
In DOI 10.1134/S1024856013010119 bzw. dessen Quellen sollte man auch entsprechende Absorptionssprekten finden.
-
Reosir
- Illumina-Mitglied
- Beiträge: 156
- Registriert: Samstag 23. Juni 2018, 11:13
- Wohnort: Süddeutschland
Die Pyrolysegase als HPLC/UV-Thema fände ich natürlich auch spannendCD-ROM-LAUFWERK hat geschrieben:Das wäre doch eine interessante Spielerei für das Usertreffen. Mit der HPLC könnte man quantitativ "alle" nicht so flüchtigen Verbindungen bestimmen. Gase wie Ethen werden halt eher entschwinden.
Danke für das Paper! Muss ich nur noch sehen, dass ich rankomme.CD-ROM-LAUFWERK hat geschrieben:Warum sollte sich das Klima für diesen Wellenlängenbereich (200 bis 290 nm) besonders interessieren?
Ich habe mir hier gerade mal die "2000 ASTM Standard Extraterrestrial Spectrum Reference" runtergeladen.
Der Bereich unter 290nm integriert gibt 9,5W ggü. 1364W des kompletten "Weltraumspektrums", also 0.7%.
In DOI 10.1134/S1024856013010119 bzw. dessen Quellen sollte man auch entsprechende Absorptionssprekten finden.
(Mittlerweile sind bei der Klimaforschung ja die direkten Effekte (z.B. mehr CO2 absorbiert mehr --> mehr Wärme bleibt auf der Erde) recht gut untersucht und wären eher weniger bedrohlich. Was jetzt aktueller ist, sind die indirekten Effekte (z.B. leichte Erwärmung einer Atmosphärenschicht --> veränderte Wolkenmuster --> veränderte Erwärmung) die theoretisch zu einer Selbstverstärkung der Erwärmung führen könnten. Die Effekte sind aber andererseits extrem komplex - wie eben Wettervorhersage auf lange Zeit allgemein. Und da würde es schon interessant sein, wenn die 0,7% in einer kleinen Schicht der Atmosphäre die Temperatur verändern und damit indirekt weitere Prozesse anstoßen. Wenn man sich tatsächlich an die Modellierung solcher Vorgänge macht, sollte die Datenbasis vollständig sein. Und das hat sich MakogonYu von dem Paper "The problem of water vapor absorption in the UV spectral range" wohl auch gedacht
-
CD-ROM-LAUFWERK
- Illumina-Mitglied
- Beiträge: 581
- Registriert: Sonntag 5. Januar 2014, 23:05
Hier kannst du das... und viel viel anderes.... finden: https://whereisscihub.now.sh/go
Nach der HPLC sollte es nicht mehr alles überlagert sein?

Nach der HPLC sollte es nicht mehr alles überlagert sein?
Ich bin mir jetzt nicht sicher, aber ich würde behaupten, dass Luftströmungen in der Mesosphäre bzw. oberen Stratosphäre keine so großen Einflüsse auf das Wetter haben. Jedenfalls ändert sich dieser nicht groß durch das bisschen UV. Unterhalb von 20km ist dann dieser Absorptionsprozess quasi beendet (Ozon). Aber zu Luftströmungen oberhalb der Jetstreams finde ich jetzt auch keine Informationen... mangels Wolken sollte es dort zumindest keine verstärkenden Effekte geben. Zu viele "vielleicht" und irgendwelche Annahmen... lassen wir das, einfach her mit einem vollständigen Spektrum!wenn die 0,7% in einer kleinen Schicht der Atmosphäre die Temperatur verändern und damit indirekt weitere Prozesse anstoßen.
-
Reosir
- Illumina-Mitglied
- Beiträge: 156
- Registriert: Samstag 23. Juni 2018, 11:13
- Wohnort: Süddeutschland
Habe eher gemeint, dass es schwierig wird, in dem Wellenlängenbereich wo bisher die überlagerten Absorptionsbanden waren, überhaupt erstmal eine saubere Basislinie zu bekommen. Denn ich habe ja die Spektren in der Gasphase gemessen und kein Lösungsmittel gehabt, das absorbieren kann. Ansonsten sollte die Trennung und Zuordnung mit HPLC/UV dann ganz gut machbar sein.CD-ROM-LAUFWERK hat geschrieben:Nach der HPLC sollte es nicht mehr alles überlagert sein?
Das scheint für Wasserdampf schwieriger zu werden, als gedacht. Nach Makogon 2013 ( https://link.springer.com/article/10.11 ... 6013010119 ):CD-ROM-LAUFWERK hat geschrieben:einfach her mit einem vollständigen Spektrum!
"Therefore, additional experiments are necessary, first of all, measurements of the spectral dependence of the water vapor
absorption cross-section over the 200–400 nm range."
Denn da scheint es allerhand eigenartige Effekte zu geben: nichtlineare Abhängigkeit der Extinktionen vom Wassergehalt, Fluoreszenz von Luft, widersprüchliche Ergebnisse selbst innerhalb des "V.E. Zuev Institute of Atmospheric Optics" (die das aber - und das muss man denen hoch anrechnen - offen zugeben).
Insgesamt lässt sich aber sagen: Die Obergrenze der wenigen angegebenen Absorptionsquerschnitte im Bereich 200 - 290 nm liegt um 10⁻²³ cm². Das entspräche einer Extinktion von etwa 10⁻²³ cm² * 2,615*10²⁰ mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,00011 für blanken Wasserdampf bei 25 °C und 1 bar. Also quasi nichts.
--> Wasserdampf dürfte im gesamten Bereich von 190 bis 365 nm für die Auswertung der UV-Spektren der Pyrolysegase vernachlässigbar sein.
-
Reosir
- Illumina-Mitglied
- Beiträge: 156
- Registriert: Samstag 23. Juni 2018, 11:13
- Wohnort: Süddeutschland
--> Obergrenze für Ethylacetat von 2 Mol-%
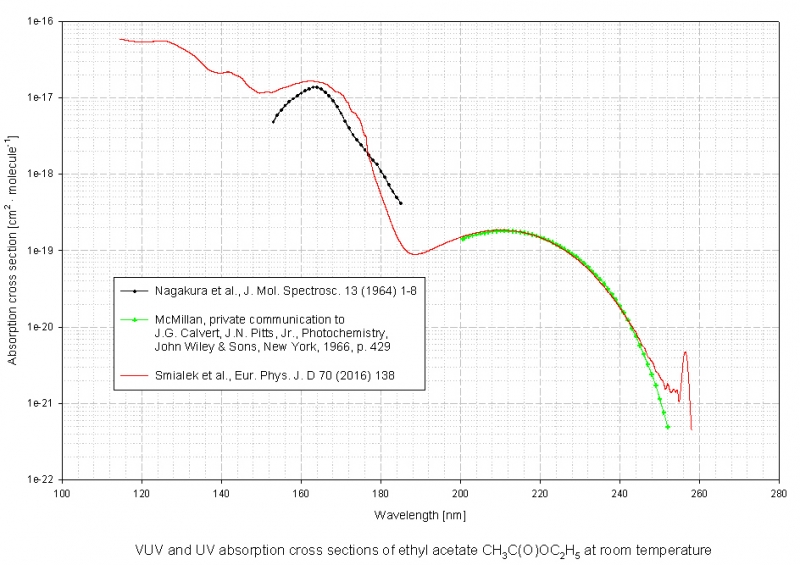
Quelle: Keller-Rudek, H. et al. - CH3C(O)OC2H5_log.jpg von http://satellite.mpic.de/spectral_atlas ... )OC2H5.spc
Der Absorptionsquerschnitt von 1.859e-19 cm²/Molekül für 210,5 nm entspräche einer Extinktion von etwa 1.859e-19 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 1,94 für blanken, idealen Ethylacetat-Dampf bei 25 °C und 1 bar. (Einzelheiten zur Berechnung siehe https://illumina-chemie.org/spiritus--gl ... html#72038). Das wäre wieder massiv übersättigter Dampf, denn an sich ist der Dampfdruck bei 26 °C nur 133 mbar ("Tabellenbuch Chemie" von Kaltofen). Gesättigter Ethylacetat-Dampf bei 26 °C hätte bei 210,5 nm eine Extinktion von etwa 1,94 * 133 mbar / 1 bar = 0,258.
Die eigenen Spektren der Mischungen haben um 210 nm zwar kein Maximum, aber zumindest die Flanke einer Bande, unter der sich eventuell etwas Ethylacetat verstecken könnte:
Der Absorptionsquerschnitt von 3.979e-21 cm²/Molekül für 256 nm entspräche einer Extinktion von etwa 3.979e-21 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,0416 für blanken, idealen Ethylacetat-Dampf bei 25 °C und 1 bar. Der gesättigte Ethylacetat-Dampf hätte dann eine Extinktion von etwa 0,0416 * 133 mbar / 1 bar = 0,00554. D.h. selbst wenn viel Ethylacetat drin ist, wäre das auf dem Untergrund der starken Bande bei 287 nm kaum zu erkennen.
Aufschlussreicher könnten die Minima der eigenen Spektren mit <0,016 um 230 nm sein. Der Absorptionsquerschnitt bei 230 nm von 7.139e-20 cm²/Molekül entspräche einer Extinktion von etwa 7.139e-20 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,747 für den blanken Ethylacetat-Dampf von oben. Der maximal mögliche Gehalt an Ethylacetat wäre damit 0,016 / 0,747 = 2,1 Mol-%. Unter der Annahme halbwegs idealen Verhaltens dann also auch 2 Vol.-%.
/Eingefügt am 31.07.2018: Der Absorptionsquerschnitt bei 211 nm von 1,8e-19 cm² ist das 1,8e-19 cm²/7.139e-20 cm² = 2,52fache des Werts beim Minimum um 230 nm. Damit wäre bei 211 nm auch nur maximal eine Absorption von Ethylacetat von <2,52*0,016 = 0,040 zu erwarten. D.h. Ethylacetat ist höchstens untergeordnet an der Bande um 206 nm beteiligt./
Ja, bei dem Überschuss an Ethylalkohol halte ich eine Veresterung prinzipiell auch für gut möglich. Aber mal sehen, was die Spektren dazu hergeben: Ethylacetat hätte hier relevante Absorptionsmaxima bei 210,5 und 256 nm:eule hat geschrieben:wenn das wirklich essigsäure ist, dann wäre der fruchtige geruch wohl nicht adehyd sondern evtl essigäther

Quelle: Keller-Rudek, H. et al. - CH3C(O)OC2H5_log.jpg von http://satellite.mpic.de/spectral_atlas ... )OC2H5.spc
Der Absorptionsquerschnitt von 1.859e-19 cm²/Molekül für 210,5 nm entspräche einer Extinktion von etwa 1.859e-19 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 1,94 für blanken, idealen Ethylacetat-Dampf bei 25 °C und 1 bar. (Einzelheiten zur Berechnung siehe https://illumina-chemie.org/spiritus--gl ... html#72038). Das wäre wieder massiv übersättigter Dampf, denn an sich ist der Dampfdruck bei 26 °C nur 133 mbar ("Tabellenbuch Chemie" von Kaltofen). Gesättigter Ethylacetat-Dampf bei 26 °C hätte bei 210,5 nm eine Extinktion von etwa 1,94 * 133 mbar / 1 bar = 0,258.
Die eigenen Spektren der Mischungen haben um 210 nm zwar kein Maximum, aber zumindest die Flanke einer Bande, unter der sich eventuell etwas Ethylacetat verstecken könnte:

Der Absorptionsquerschnitt von 3.979e-21 cm²/Molekül für 256 nm entspräche einer Extinktion von etwa 3.979e-21 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,0416 für blanken, idealen Ethylacetat-Dampf bei 25 °C und 1 bar. Der gesättigte Ethylacetat-Dampf hätte dann eine Extinktion von etwa 0,0416 * 133 mbar / 1 bar = 0,00554. D.h. selbst wenn viel Ethylacetat drin ist, wäre das auf dem Untergrund der starken Bande bei 287 nm kaum zu erkennen.
Aufschlussreicher könnten die Minima der eigenen Spektren mit <0,016 um 230 nm sein. Der Absorptionsquerschnitt bei 230 nm von 7.139e-20 cm²/Molekül entspräche einer Extinktion von etwa 7.139e-20 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,747 für den blanken Ethylacetat-Dampf von oben. Der maximal mögliche Gehalt an Ethylacetat wäre damit 0,016 / 0,747 = 2,1 Mol-%. Unter der Annahme halbwegs idealen Verhaltens dann also auch 2 Vol.-%.
/Eingefügt am 31.07.2018: Der Absorptionsquerschnitt bei 211 nm von 1,8e-19 cm² ist das 1,8e-19 cm²/7.139e-20 cm² = 2,52fache des Werts beim Minimum um 230 nm. Damit wäre bei 211 nm auch nur maximal eine Absorption von Ethylacetat von <2,52*0,016 = 0,040 zu erwarten. D.h. Ethylacetat ist höchstens untergeordnet an der Bande um 206 nm beteiligt./
-
Reosir
- Illumina-Mitglied
- Beiträge: 156
- Registriert: Samstag 23. Juni 2018, 11:13
- Wohnort: Süddeutschland
--> Essigsäure ist zu maximal 6 Mol-% enthalten. Es gibt zumindest einen zweiten Bestandteil, der um 206 nm stark absorbiert.
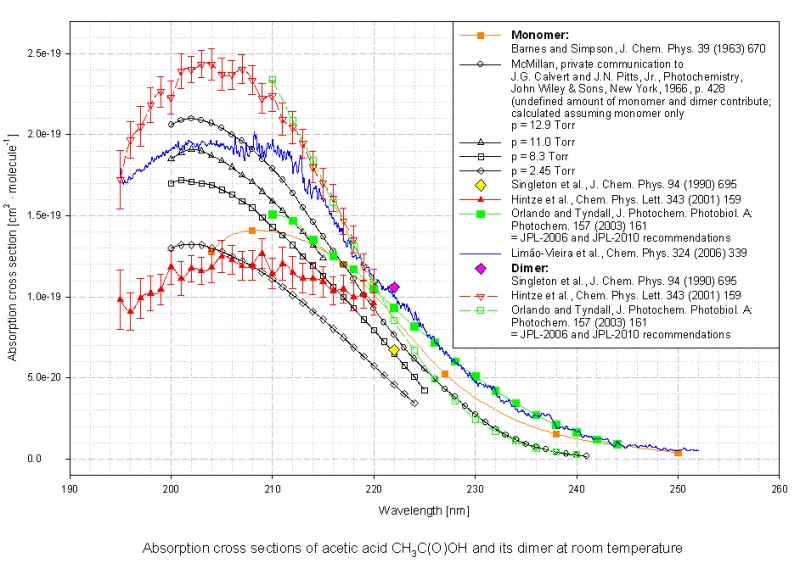
Quelle: Keller-Rudek, H. et al. - CH3C(O)OH_and dimer_195-252nm_lin.jpg von http://satellite.mpic.de/spectral_atlas ... C(O)OH.spc
Das passt schon mal gut zur Wellenlänge des Maximums im Pyrolysegas von 206 nm. Allerdings ist dort wegen des Anstiegs nach 190 nm hin und der leichten Schulter um 220 nm zu vermuten, dass unter dem Maximum mehrere Absorptionsbanden liegen könnten. Nehmen wir trotzdem testweise mal an, dass die Essigsäure den Hauptteil der Absorption ausmacht: Der Absorptionsquerschnitt um 206 nm liegt je nach Quelle und Monomer bzw. Dimer bei 1,2e-19 bis 2,4e-19 cm². Das entspräche einer Extinktion von etwa 1,2e-19 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 1,255 (bzw. bis 2,51) für blanken, idealen Essigsäure-Dampf bei 25 °C und 1 bar. (Einzelheiten zur Berechnung siehe https://illumina-chemie.org/spiritus--gl ... html#72038). Das wäre wieder massiv übersättigter Dampf, denn an sich ist der Dampfdruck bei 29 °C nur 27 mbar ("Tabellenbuch Chemie" von Kaltofen). Gesättigter Essigsäure-Dampf bei 29 °C hätte damit eine Extinktion von etwa 1,255 * 27 mbar / 1 bar = 0,034 (bzw. bis 0,068) (Vernachlässigung der Wärmeausdehnung). Da liegt die maximale Absorption im gemessenen Spektrum um 206 nm mit etwa 0,76 weit höher. Und selbst wenn man nur die Differenz zwischen dem Minimum um 195 nm und dem Maximum betrachtet, ist die mit bis zu über 0,12 noch größer. D.h. die Bande bei 206 nm kann nicht (allein) durch gesättigten Essigsäuredampf erklärt werden.
Ein weiterer Ansatzpunkt sind wieder die Minima der eigenen Spektren mit <0,016 um 230 nm. Der Absorptionsquerschnitt bei 230 nm von minimal 2.45e-20 cm² (Dimer nach Orlando) entspräche einer Extinktion von etwa 2.45e-20 cm² * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,256 für den blanken Essigsäure-Dampf von oben. Der maximal mögliche Gehalt an Essigsäure wäre damit 0,016 / 0,256 = 6,25 Mol-%. Mit einem Verhältnis der Absorptionsquerschnitte von 230 nm zu 206 nm zwischen 1:4 und 1:10 wäre eine Obergrenze der Extinktion am Maximum von 10 * 0,256 = 2,6 zu erwarten. Das würde den gemessenen Spektren zumindest nicht widersprechen.
--> Essigsäure ist zu maximal 6 Mol-% enthalten. Es gibt zumindest einen zweiten Bestandteil, der um 206 nm stark absorbiert.
Bei der Essigsäure ist die Sache etwas komplizierter, weil auch das Dimer im Gleichgewicht vorliegen kann und leicht andere Absorptionseigenschaften hat und weil die Literaturquellen ziemlich unterschiedliche Spektren angeben. Im Schnitt hätte das Monomer aber ein flaches Maximum bei etwa 207 nm, das Dimer um 205 nm:lemmi hat geschrieben:Es könnten sicher auch Essigsäure und Ethylacetat entstehen, wenn nicht sogar niedermolekulare Spaltprodukte (Methanal, Methan etc).

Quelle: Keller-Rudek, H. et al. - CH3C(O)OH_and dimer_195-252nm_lin.jpg von http://satellite.mpic.de/spectral_atlas ... C(O)OH.spc
Das passt schon mal gut zur Wellenlänge des Maximums im Pyrolysegas von 206 nm. Allerdings ist dort wegen des Anstiegs nach 190 nm hin und der leichten Schulter um 220 nm zu vermuten, dass unter dem Maximum mehrere Absorptionsbanden liegen könnten. Nehmen wir trotzdem testweise mal an, dass die Essigsäure den Hauptteil der Absorption ausmacht: Der Absorptionsquerschnitt um 206 nm liegt je nach Quelle und Monomer bzw. Dimer bei 1,2e-19 bis 2,4e-19 cm². Das entspräche einer Extinktion von etwa 1,2e-19 cm²/Molekül * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 1,255 (bzw. bis 2,51) für blanken, idealen Essigsäure-Dampf bei 25 °C und 1 bar. (Einzelheiten zur Berechnung siehe https://illumina-chemie.org/spiritus--gl ... html#72038). Das wäre wieder massiv übersättigter Dampf, denn an sich ist der Dampfdruck bei 29 °C nur 27 mbar ("Tabellenbuch Chemie" von Kaltofen). Gesättigter Essigsäure-Dampf bei 29 °C hätte damit eine Extinktion von etwa 1,255 * 27 mbar / 1 bar = 0,034 (bzw. bis 0,068) (Vernachlässigung der Wärmeausdehnung). Da liegt die maximale Absorption im gemessenen Spektrum um 206 nm mit etwa 0,76 weit höher. Und selbst wenn man nur die Differenz zwischen dem Minimum um 195 nm und dem Maximum betrachtet, ist die mit bis zu über 0,12 noch größer. D.h. die Bande bei 206 nm kann nicht (allein) durch gesättigten Essigsäuredampf erklärt werden.
Ein weiterer Ansatzpunkt sind wieder die Minima der eigenen Spektren mit <0,016 um 230 nm. Der Absorptionsquerschnitt bei 230 nm von minimal 2.45e-20 cm² (Dimer nach Orlando) entspräche einer Extinktion von etwa 2.45e-20 cm² * 2,615e20 mol⁻¹ * 0,04 mol l⁻¹ * 1 cm = 0,256 für den blanken Essigsäure-Dampf von oben. Der maximal mögliche Gehalt an Essigsäure wäre damit 0,016 / 0,256 = 6,25 Mol-%. Mit einem Verhältnis der Absorptionsquerschnitte von 230 nm zu 206 nm zwischen 1:4 und 1:10 wäre eine Obergrenze der Extinktion am Maximum von 10 * 0,256 = 2,6 zu erwarten. Das würde den gemessenen Spektren zumindest nicht widersprechen.
--> Essigsäure ist zu maximal 6 Mol-% enthalten. Es gibt zumindest einen zweiten Bestandteil, der um 206 nm stark absorbiert.