Silbernitrat nach EP0568259A1
Moderatoren: Moderatoren, Assistenten
-
Glaskocher
- Illumina-Mitglied
- Beiträge: 2534
- Registriert: Dienstag 27. Oktober 2015, 22:17
- Wohnort: Leverkusen
Das Tonen von Schwarz-Weiß-Fotos bei Prof. Blume: http://www.chemieunterricht.de/dc2/foto/foto-tonung.htm
Eine interessante Art, Farbe in die Graustufen zu bekommen (monochrom). Dort sollte auch Etwas zum Bleichen von Silberflecken auffindbar sein...
(Artikel mit mehreren experimentell nachvollziehbaren Vorschriften)
Eine interessante Art, Farbe in die Graustufen zu bekommen (monochrom). Dort sollte auch Etwas zum Bleichen von Silberflecken auffindbar sein...
(Artikel mit mehreren experimentell nachvollziehbaren Vorschriften)
- mgritsch
- Illumina-Admin
- Beiträge: 4375
- Registriert: Montag 8. Mai 2017, 10:26
- Wohnort: in den Misanthropen
Genau genommen das hier:
http://www.chemieunterricht.de/dc2/foto ... eichen.htm
http://www.chemieunterricht.de/dc2/foto ... eichen.htm
Auf Haut und glatten Flächen hatte ich das mal erfolgreich probiert, glaube ich. Von nem lackierten Tisch gingen die Silberflecken damit nicht weg, aber bei Emaille sollte es klappen.lemmi hat geschrieben:Hast du das mal gemacht?Pok hat geschrieben:Silberflecken kann man doch leicht mit Lugolscher Lösung und anschließend Thiosulfat entfernen.
Kleiner Nachtrag zur Stabilität von Salpetersäure-Wasserstoffperoxid-Mischungen:
http://hydrogen-peroxide.us/chemical-ca ... s-2005.pdf
Bj68
http://hydrogen-peroxide.us/chemical-ca ... s-2005.pdf
Bj68
Ein bisschen komisch finde ich das ja. Erst schreiben sie, H2O2 würde zur Oxidation von Stickoxiden zu Salpetersäure verwendet und dann sollen durch die Reaktion von Salpetersäure mit H2O2 wieder Stickoxide entstehen!?
Auch das Schaubild ist sehr fragwürdig. Wenn man nach links extrapoliert ist Salpetersäure von >75% auch ohne jedes H2O2 "highly reactive". Und die rechte obere Ecke des Schaubilds entspricht einer Mischung aus 90 % Salpetersäure und 34 % H2O2 - Naja, wahrscheinlich muss man einfach nur einen ganz großen Kolben nehmen, in den mehr als 100 % hineinpassen
Auch das Schaubild ist sehr fragwürdig. Wenn man nach links extrapoliert ist Salpetersäure von >75% auch ohne jedes H2O2 "highly reactive". Und die rechte obere Ecke des Schaubilds entspricht einer Mischung aus 90 % Salpetersäure und 34 % H2O2 - Naja, wahrscheinlich muss man einfach nur einen ganz großen Kolben nehmen, in den mehr als 100 % hineinpassen
"Alles sollte so einfach wie möglich gemacht werden. Aber nicht einfacher." (A. Einstein 1871 - 1955)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)
-
CD-ROM-LAUFWERK
- Illumina-Mitglied
- Beiträge: 581
- Registriert: Sonntag 5. Januar 2014, 23:05
Deren Quelle, hier, beschreibt Mischungen von HNO3 von 58...100% mit H2O2 von 62,9%.
Sie schreiben dann auch, dass diese Zersetzlichkeit "in line with the instability of nitric acid itself of concentrations above 70%" wäre... ich denke wir wissen alle, wie unglaublich instabil HNO3 von >70% ist... Das ist daher eine sehr komische Aussage.
Keine Ahnung, wieso sie das als Quelle für ihr Diagramm angeben. Dort findet sich zwar auch ein Diagramm, aber das hat nicht wirklich etwas mit dem zu tun, was sie dort darstellen. Also es gibt in der angegebenen Quelle der Daten einfach nicht die Daten... oder? Rechnen wir mal nach:
Es gibt dort dieses Diagramm:
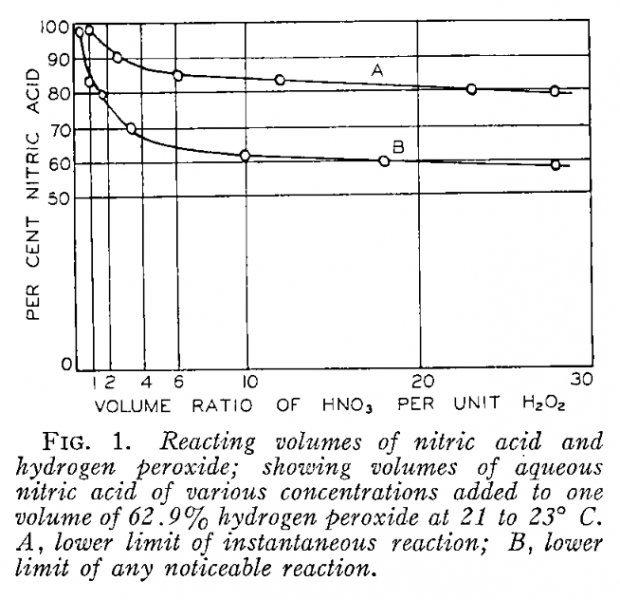
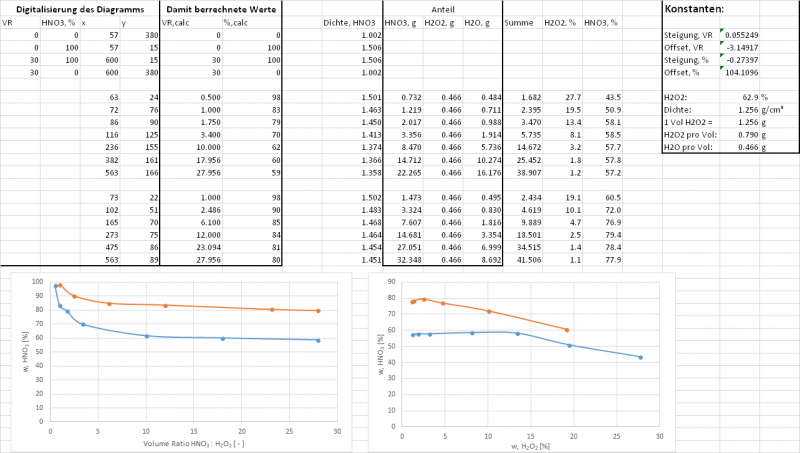
Die selben Daten digitalisiert:
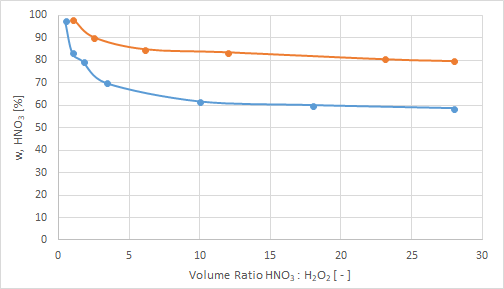
Umgerechnet von Volumen auf Masse und dann in die % im Diagramm wie von Solvay aufgetragen:
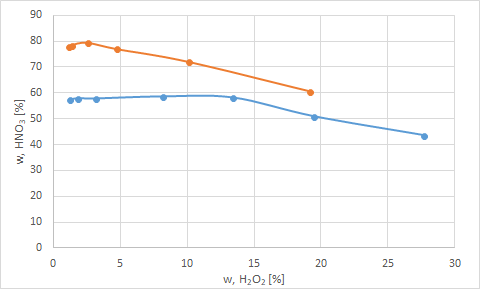
Sieht diese Darstellung irgendwie aus wie diese hier? (Die Farben wären dann rot bei allem über der orangenen Linie, orange alles zwischen den beiden Linien und grün unterhalb der blauen Linie):
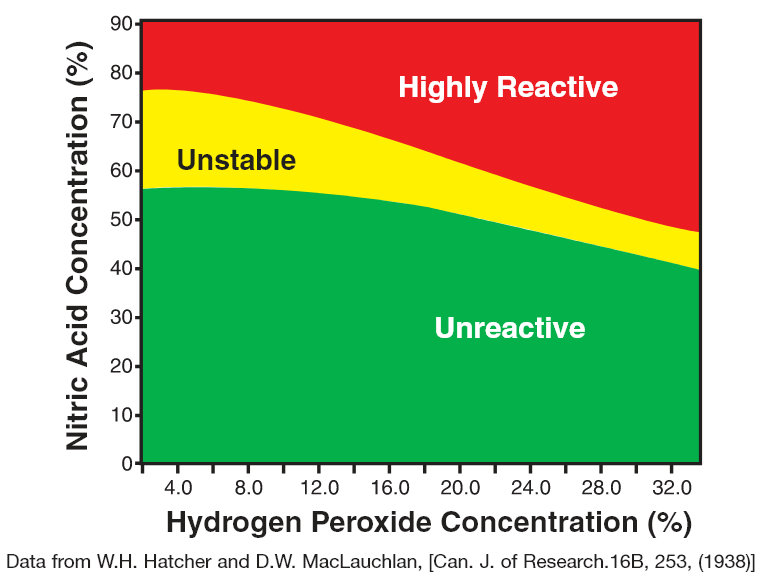
Ja, das sieht tatsächlich so aus, wenn auch ein paar Punkte nicht ganz korrekt sind sowie extrapoliert wurden.
Zweifelhaft bleiben die Zahlen natürlich trotzdem, auch wenn dort jemand in 30min halbwegs korrekt Werte abgeschrieben und umgerechnet hat.
Wenn mal jemand testweise 50% H2O2 mit 100% HNO3 1:1 sowie 1:5 (Volumenanteile) mischen könnte, wäre es ganz interessant zu sehen, was passiert. Die Mischung 1:1 wäre dann im "mittleren" (gelben) Bereich bei 20% H2O2 und 60% HNO3 bzw. bei 1:5 deutlich im "roten" Bereich bei 5,5% H2O2 mit 89% HNO3. Wenn ich daran denke, kann ich das mal in ~1 Monat machen.
Die Tabelle dazu sah dann übrigens so aus, wobei die Zuordnung Dichte<->Konzentration für HNO3 auf einem anderen Blatt stattfand und der Faulheit halber einfach mit einem Polynom 4. Grades recht gut angenähert wurde:
Sie schreiben dann auch, dass diese Zersetzlichkeit "in line with the instability of nitric acid itself of concentrations above 70%" wäre... ich denke wir wissen alle, wie unglaublich instabil HNO3 von >70% ist... Das ist daher eine sehr komische Aussage.
Keine Ahnung, wieso sie das als Quelle für ihr Diagramm angeben. Dort findet sich zwar auch ein Diagramm, aber das hat nicht wirklich etwas mit dem zu tun, was sie dort darstellen. Also es gibt in der angegebenen Quelle der Daten einfach nicht die Daten... oder? Rechnen wir mal nach:
Es gibt dort dieses Diagramm:

Die selben Daten digitalisiert:

Umgerechnet von Volumen auf Masse und dann in die % im Diagramm wie von Solvay aufgetragen:

Sieht diese Darstellung irgendwie aus wie diese hier? (Die Farben wären dann rot bei allem über der orangenen Linie, orange alles zwischen den beiden Linien und grün unterhalb der blauen Linie):

Ja, das sieht tatsächlich so aus, wenn auch ein paar Punkte nicht ganz korrekt sind sowie extrapoliert wurden.
Zweifelhaft bleiben die Zahlen natürlich trotzdem, auch wenn dort jemand in 30min halbwegs korrekt Werte abgeschrieben und umgerechnet hat.
Wenn mal jemand testweise 50% H2O2 mit 100% HNO3 1:1 sowie 1:5 (Volumenanteile) mischen könnte, wäre es ganz interessant zu sehen, was passiert. Die Mischung 1:1 wäre dann im "mittleren" (gelben) Bereich bei 20% H2O2 und 60% HNO3 bzw. bei 1:5 deutlich im "roten" Bereich bei 5,5% H2O2 mit 89% HNO3. Wenn ich daran denke, kann ich das mal in ~1 Monat machen.
Die Tabelle dazu sah dann übrigens so aus, wobei die Zuordnung Dichte<->Konzentration für HNO3 auf einem anderen Blatt stattfand und der Faulheit halber einfach mit einem Polynom 4. Grades recht gut angenähert wurde:

