Modifizierte Fehlingsche Probe
Moderatoren: Moderatoren, Assistenten
Lächerlich ist hier nur dein Kommentar, in dem du jetzt plötztlich eine 180°-Wende machst. Du warst es, dem hier die Frage zur Existenz von CuOH ach so wichtig war, dass du dich darüber ausführlich ausgelassen hast. Meine links waren ausschließlich an dich gerichtet. Im Gegensatz zu dir erwarte ich von ihm nicht, das er die aktuelle Literatur zur Existenz irgendwelcher Verbindungen durchforstet.
Es "schaut so aus"? Selbst wenn er eine Analogie zu Cu(OH)2 hergestellt hätte, gäbe es hier keinen Grund zu kritisieren. Denn die Überlegung ist richtig und in Übereinstimmung mit der Literatur. Es ist eine unsinnig komplizierte Vermutung, anzunehmen, er wäre von alleine rein zufällig auf dieselbe Lösung gekommen, wie sie in der Literatur beschrieben ist. Der Komplexbildner hält auch überhaupt nicht "alles Kupfer in Lösung". Sonst würde am Ende nicht Cu2O ausfallen. Wenn Zucker verbraucht wird und das Oxidationsprodukt nicht mehr komplexierend wirkt, gibt es gar keinen Komplex mehr. Es macht demnach absolut Sinn, anzunehmen, dass CuOH als real existierendes Zwischenprodukt entsteht. Die Stabilität von Komplexen ist außerdem stark von der Ladung des Zentralatoms abhängig. Selbst Zuckerüberschuss muss noch längst nicht bedeuten, dass der Zucker neben Cu2+- auch Cu+-Ionen komplexiert! Dass CuOH existiert, hat (dir!) hoffentlich der zweite link bewiesen. Das hättest du erstmal selbst googeln sollen, ehe du hier Zweifel aufkommen lässt.
Insgesamt ist deine Kritik völlig überzogen und offenbart nur deine eigenen Ängste, selbst was zu veröffentlichen. Die sind aber nicht Maßstab für die Bewertung der Artikel anderer User.
Es "schaut so aus"? Selbst wenn er eine Analogie zu Cu(OH)2 hergestellt hätte, gäbe es hier keinen Grund zu kritisieren. Denn die Überlegung ist richtig und in Übereinstimmung mit der Literatur. Es ist eine unsinnig komplizierte Vermutung, anzunehmen, er wäre von alleine rein zufällig auf dieselbe Lösung gekommen, wie sie in der Literatur beschrieben ist. Der Komplexbildner hält auch überhaupt nicht "alles Kupfer in Lösung". Sonst würde am Ende nicht Cu2O ausfallen. Wenn Zucker verbraucht wird und das Oxidationsprodukt nicht mehr komplexierend wirkt, gibt es gar keinen Komplex mehr. Es macht demnach absolut Sinn, anzunehmen, dass CuOH als real existierendes Zwischenprodukt entsteht. Die Stabilität von Komplexen ist außerdem stark von der Ladung des Zentralatoms abhängig. Selbst Zuckerüberschuss muss noch längst nicht bedeuten, dass der Zucker neben Cu2+- auch Cu+-Ionen komplexiert! Dass CuOH existiert, hat (dir!) hoffentlich der zweite link bewiesen. Das hättest du erstmal selbst googeln sollen, ehe du hier Zweifel aufkommen lässt.
Insgesamt ist deine Kritik völlig überzogen und offenbart nur deine eigenen Ängste, selbst was zu veröffentlichen. Die sind aber nicht Maßstab für die Bewertung der Artikel anderer User.
Es ist unschön mit anzusehen, wie solche Diskussionen persönlich werden. Damit sollte an der Stelle auch Schluss sein, themenbezogene Diskussionen sind sinnvoll - dieses persönliche "Runtergemacht" klärt ihr bitte unter euch.
Zum Versuch: Hier wird eindrucksvoll bestätigt, warum ich mich gegen vermeintlich "simple" Versuche von Anfängern ausgesprochen habe. Zum einen ist dieser Versuch alles andere als simpel, da die Chemie dahinter recht aufwändig ist und viele Teilgebiete der Chemie abdeckt zum anderen gehört eine gewisse Erfahrung dazu. Die Modifikation der Fehling-Probe halte ich zum einen für unnötig, da sie an dieser Stelle nicht wirklich gewinnbringend ist. Sinn der Fehling-Reagenz ist es Kuper(II) immer in Lösung zu halten, das ist wichtig um ein eindeutiges Testresultat zu bekommen. Das ist bei diesem Versuch nicht so, sondern man soll anfangen Farben zu unterscheiden. Wenn das nur immer so eindeutig wäre, wäre das ja halb so wild - ist es aber nicht.

Nicht zuletzt fehlt für dieses Bild die Auswertung. Ist Saccharose nun Positiv oder nicht? Wo zwischen "Kupferrot und orange" ist matschgrün angesiedelt? In der Erklärung steht, eine schwarze Farbe heißt negativ, matschgrün ist kein schwarz, also positiv. Dieser Versuch ist aber nicht positiv.
Dazu kommt auch, dass man innerhalb dieser Diskussion gemerkt hat, dass der Versuch gar nicht so leicht ist wie am Anfang gedacht. Man müsste noch genauer auf die Komplexbildung mit Zuckern eingehen (vgl. Schweizer Reagenz), erklären warum der Nachweis überhaupt funktioniert obwohl die Aldehydform von Zuckern kaum vorliegt. Und letztendlich sollte man passendere Beispiele heraussuchen. Was passiert mit OH-geschützen Zuckern (natürlich mit freier Glycosidischer OH-Gruppe) Diese sind nicht als Analyten geeignet, da die das Kupfer u.U. gar nicht komplexieren!? "Haushaltszucker" ist genau eines der Beispiele an denen man erklären kann, dass vor dem Nachweis evtl eine Hydrolyse der Zucker notwendig sein kann. Apfelsaft enthält - wenn auch wenig - Ascorbinsäure und Traubensaft Cyanidine welche mit Kupfer ebenfalls Komplexe bilden können und in basischen Lösungen Farbänderungen Zeigen. Den Analyten hier als Liganden zu nehmen ist grenzwertig, nicht ohne Grund benutzen die üblichen Reagenzen Tartrate oder Citrate. Die Modifikation schränkt sich selbst enorm ein: Sie stellt mehr Voraussetzungen an den Analyten, erfordert größere Mengen Analyt, ihre Auswertung ist ungenauer - alles Nachteile welche die unmodifizierte Fehling-Probe nicht hat. Der Versuch ist also nicht als "analytische Methode" geeignet, sondern dient lediglich dazu zu zeigen was passiert wenn Kupfer im Alkalischen Reduziert wird.
Man kann also noch einiges mehr erklären um diesen Versuch verständlich zu machen, wo man die Grenze zieht und sagt, dass es ausreichend ist muss man natürlich sehen.
Zum Versuch: Hier wird eindrucksvoll bestätigt, warum ich mich gegen vermeintlich "simple" Versuche von Anfängern ausgesprochen habe. Zum einen ist dieser Versuch alles andere als simpel, da die Chemie dahinter recht aufwändig ist und viele Teilgebiete der Chemie abdeckt zum anderen gehört eine gewisse Erfahrung dazu. Die Modifikation der Fehling-Probe halte ich zum einen für unnötig, da sie an dieser Stelle nicht wirklich gewinnbringend ist. Sinn der Fehling-Reagenz ist es Kuper(II) immer in Lösung zu halten, das ist wichtig um ein eindeutiges Testresultat zu bekommen. Das ist bei diesem Versuch nicht so, sondern man soll anfangen Farben zu unterscheiden. Wenn das nur immer so eindeutig wäre, wäre das ja halb so wild - ist es aber nicht.

Nicht zuletzt fehlt für dieses Bild die Auswertung. Ist Saccharose nun Positiv oder nicht? Wo zwischen "Kupferrot und orange" ist matschgrün angesiedelt? In der Erklärung steht, eine schwarze Farbe heißt negativ, matschgrün ist kein schwarz, also positiv. Dieser Versuch ist aber nicht positiv.
Dazu kommt auch, dass man innerhalb dieser Diskussion gemerkt hat, dass der Versuch gar nicht so leicht ist wie am Anfang gedacht. Man müsste noch genauer auf die Komplexbildung mit Zuckern eingehen (vgl. Schweizer Reagenz), erklären warum der Nachweis überhaupt funktioniert obwohl die Aldehydform von Zuckern kaum vorliegt. Und letztendlich sollte man passendere Beispiele heraussuchen. Was passiert mit OH-geschützen Zuckern (natürlich mit freier Glycosidischer OH-Gruppe) Diese sind nicht als Analyten geeignet, da die das Kupfer u.U. gar nicht komplexieren!? "Haushaltszucker" ist genau eines der Beispiele an denen man erklären kann, dass vor dem Nachweis evtl eine Hydrolyse der Zucker notwendig sein kann. Apfelsaft enthält - wenn auch wenig - Ascorbinsäure und Traubensaft Cyanidine welche mit Kupfer ebenfalls Komplexe bilden können und in basischen Lösungen Farbänderungen Zeigen. Den Analyten hier als Liganden zu nehmen ist grenzwertig, nicht ohne Grund benutzen die üblichen Reagenzen Tartrate oder Citrate. Die Modifikation schränkt sich selbst enorm ein: Sie stellt mehr Voraussetzungen an den Analyten, erfordert größere Mengen Analyt, ihre Auswertung ist ungenauer - alles Nachteile welche die unmodifizierte Fehling-Probe nicht hat. Der Versuch ist also nicht als "analytische Methode" geeignet, sondern dient lediglich dazu zu zeigen was passiert wenn Kupfer im Alkalischen Reduziert wird.
Man kann also noch einiges mehr erklären um diesen Versuch verständlich zu machen, wo man die Grenze zieht und sagt, dass es ausreichend ist muss man natürlich sehen.
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
"Kupferrot bis orange" umfasst nicht viele Farben. Eigentlich nur rot und orange, wenn man sich Farbkreis, Lichtspektrum o.ä. ansieht. Grün ist die Komplementärfarbe und da gibt es m.E. keinerlei Gefahr einer Verwechselung. Allerdings kann man sich die Frage stellen, wie das Grün zustande kommt. Es wäre durch die Mischung von gelb und blau zu erklären, was bedeuten könnte, dass ein geringer Teil doch reduziert wird zu gelbem CuOH/Cu2O und überschüssiges, blaues Cu2+ übrig bleibt.
Auch wenn die Modifikation nicht viele Vorteile bietet und das Ergebnis weniger deutlich ist, macht es Sinn, sowas auch als Artikel zu veröffentlichen. Alleine schon als "Bewertung" der Vorschrift aus dem Buch. Es ist eine in der Literatur beschriebene Variante und damit auch wert, nachgekocht und beurteilt zu werden. Die Beurteilung ist noch nicht ausreichend im Artikel, aber das kann man noch machen.
Man kann die Erklärung beliebig kompliziert machen. Eine Anfänger-Rubrik hätte den Vorteil, die Erklärung abzukürzen, damit sie nicht nur von Anfängern geschrieben, sondern auch von anderen Anfängern verstanden wird. Wenn man das will, dann reicht es völlig aus zu sagen, dass der Zucker selbst als Ligand dient und sonst alles im Wesentlichen wie bei der normalen Fehlingreaktion abläuft. Für die genauere Erklärung kann man auf den alten Fehling-Artikel verweisen. Es macht kaum Sinn, das alles doppelt zu schreiben.
Die Fehlingprobe ist sowieso nicht wegen ihres Charakters als haargenaue analytische Methode berühmt, sondern als Schulmethode zur Einführung auf grundlegendem Niveau. Auch beim alten Fehling-Artikel wurden keine analytischen Mengen an Probe eingesetzt, sondern ein ganzes Gramm. Auch die kaum frei vorliegende Aldehydgruppe wird da nicht erwähnt. Auch da ist die Rede von CuOH. Wenn das ein Artikel wurde, muss der hier auch einer werden. Es gibt noch dutzende andere Artikel, die noch wortkarger sind, fragwürdige Produkte zeigen, usw. und trotzdem angenommen wurden. Wenn man das Niveau unbedingt hoch halten will, sollte man eine Anfänger-Kategorie einfügen oder das hier ebenfalls zulassen, wenn die wenigen offensichtlichen Mängel noch behoben werden. Alles andere wäre absolut unfair.
Es gibt noch dutzende andere Artikel, die noch wortkarger sind, fragwürdige Produkte zeigen, usw. und trotzdem angenommen wurden. Wenn man das Niveau unbedingt hoch halten will, sollte man eine Anfänger-Kategorie einfügen oder das hier ebenfalls zulassen, wenn die wenigen offensichtlichen Mängel noch behoben werden. Alles andere wäre absolut unfair.
Auch wenn die Modifikation nicht viele Vorteile bietet und das Ergebnis weniger deutlich ist, macht es Sinn, sowas auch als Artikel zu veröffentlichen. Alleine schon als "Bewertung" der Vorschrift aus dem Buch. Es ist eine in der Literatur beschriebene Variante und damit auch wert, nachgekocht und beurteilt zu werden. Die Beurteilung ist noch nicht ausreichend im Artikel, aber das kann man noch machen.
Man kann die Erklärung beliebig kompliziert machen. Eine Anfänger-Rubrik hätte den Vorteil, die Erklärung abzukürzen, damit sie nicht nur von Anfängern geschrieben, sondern auch von anderen Anfängern verstanden wird. Wenn man das will, dann reicht es völlig aus zu sagen, dass der Zucker selbst als Ligand dient und sonst alles im Wesentlichen wie bei der normalen Fehlingreaktion abläuft. Für die genauere Erklärung kann man auf den alten Fehling-Artikel verweisen. Es macht kaum Sinn, das alles doppelt zu schreiben.
Die Fehlingprobe ist sowieso nicht wegen ihres Charakters als haargenaue analytische Methode berühmt, sondern als Schulmethode zur Einführung auf grundlegendem Niveau. Auch beim alten Fehling-Artikel wurden keine analytischen Mengen an Probe eingesetzt, sondern ein ganzes Gramm. Auch die kaum frei vorliegende Aldehydgruppe wird da nicht erwähnt. Auch da ist die Rede von CuOH. Wenn das ein Artikel wurde, muss der hier auch einer werden.
Ich möchte das nochmal zitieren:
Selbst Soroka et al. spekulieren nur, dass kolloides CuOH als Intermediat auftreten könnte. Solange wir hier nicht versuchen, den Mechanismus im Einzelnen aufzuklären, ist das wohl irrelevant. Ob das Kupfer(I)oxid aus einem Kupfer(I)-Glukonsäurekomplex entsteht, oder welche Zusammensetzung die ersten Nanopartikel haben, das ist nicht zu sagen. Worum es mir ging, war die ganze Zeit die völlige Verdrehung der Verhältnisse in seiner Erklärung. Nicht die Zersetzung des Kupfer(I)hydroxides ist langsam und erfordert Hitze, sondern die Redoxreaktion mit der Glukose.
Das ist auch nicht unbedingt ein Wunder, da die Glukose die meiste Zeit in geschlossener Form vorliegt. Mit genug Geduld und Hitze reagiert durch Keto-Enol-Tautomerie auch Fruktose. Das ist alles noch Schulbuchniveau.
Andersrum wird das auch in keinem Chemiebuch stehen.
Das Kupfer(I)hydroxid aus deinem Artikel wird als gelb beschrieben. Er beschreibt aber die Farbe seiner Lösungen vor dem Erhitzen nicht als gelb. Kupfer(I)hydroxid ist allenfalls ein kurzlebiges Intermediat, das in dem Reaktionsmechanismus auftauchen könnte, aber das fordert keiner, sowas ist zu schwer.Die Färbung nach der Zugabe von NaOH ist leider etwas verfälscht. Als ich das NaOH hinzugab, setzte die Reaktion in einem sehr kleinen Gebiet ein. Durch die Reaktionswärme zerfiel bereits etwas Kupfer(I)-hydroxid zu Kupfer(I)-oxid.
Bei der Zugabe von NaOH bildet sich dankt dem Komplex Kupfer(I)-hydroxid und kein Kupfer(II)-hydroxid, welches in der Hitze zu Kupfer(II)-oxid zerfallen würde (schwarze Farbe bei negative ausfallender Reaktion). Kupfer(I)-hydroxid zersetzt sich in der Hitze zu Kupfer(I)-oxid, weil das Hydroxid in der Hitze nicht bestänig ist.
Selbst Soroka et al. spekulieren nur, dass kolloides CuOH als Intermediat auftreten könnte. Solange wir hier nicht versuchen, den Mechanismus im Einzelnen aufzuklären, ist das wohl irrelevant. Ob das Kupfer(I)oxid aus einem Kupfer(I)-Glukonsäurekomplex entsteht, oder welche Zusammensetzung die ersten Nanopartikel haben, das ist nicht zu sagen. Worum es mir ging, war die ganze Zeit die völlige Verdrehung der Verhältnisse in seiner Erklärung. Nicht die Zersetzung des Kupfer(I)hydroxides ist langsam und erfordert Hitze, sondern die Redoxreaktion mit der Glukose.
Das ist auch nicht unbedingt ein Wunder, da die Glukose die meiste Zeit in geschlossener Form vorliegt. Mit genug Geduld und Hitze reagiert durch Keto-Enol-Tautomerie auch Fruktose. Das ist alles noch Schulbuchniveau.
Andersrum wird das auch in keinem Chemiebuch stehen.
Wenn die Menschen und die Dschinn sich zusammentäten, etwas, das diesem Post gleicht, zustande zu bringen, würde ihnen das nicht gelingen – selbst wenn sie einander helfen würden.
Es ist ein Drahtseilakt, genau das zu schreiben, was dir passt. Erst war es zu wenig, jetzt ist es zu detailliert.
"Kupfer(I)-hydroxid CuOH ist schwerlöslich und fällt als hellgelber Niederschlag aus.
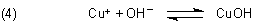
Eine möglicherweise etwas rötliche Färbung des Niederschlags rührt daher, dass sich daneben durch hitzebedingte Wasserabspaltung auch Kupfer(I)-oxid Cu2O bildet." - http://www.chemieunterricht.de/dc2/tip/10_10.htm
Klar hattest du auch das kritisiert, worum es dir jetzt angeblich geht. Der Punkt ist auch richtig, aber wirklich nicht dramatisch. Er hat lediglich nicht explizit erwähnt, dass die Hitze auch für die Reduktion nötig ist. Aber du hast noch mehr kritisiert bzw. bezweifelt: dass seine Vorstellung des thermischen Zerfalls von CuOH falsch seien, dass CuOH nicht auftritt, dass CuOH nicht existiert. Das alles war falsch.
EDIT: den Artikel hatte ich als Beweis für die von dir bezweifelte Existenz von CuOH verlinkt und nicht als Beweis für ein Intermediat bei dieser speziellen Reaktion.
"Kupfer(I)-hydroxid CuOH ist schwerlöslich und fällt als hellgelber Niederschlag aus.
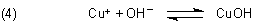
Eine möglicherweise etwas rötliche Färbung des Niederschlags rührt daher, dass sich daneben durch hitzebedingte Wasserabspaltung auch Kupfer(I)-oxid Cu2O bildet." - http://www.chemieunterricht.de/dc2/tip/10_10.htm
Klar hattest du auch das kritisiert, worum es dir jetzt angeblich geht. Der Punkt ist auch richtig, aber wirklich nicht dramatisch. Er hat lediglich nicht explizit erwähnt, dass die Hitze auch für die Reduktion nötig ist. Aber du hast noch mehr kritisiert bzw. bezweifelt: dass seine Vorstellung des thermischen Zerfalls von CuOH falsch seien, dass CuOH nicht auftritt, dass CuOH nicht existiert. Das alles war falsch.
EDIT: den Artikel hatte ich als Beweis für die von dir bezweifelte Existenz von CuOH verlinkt und nicht als Beweis für ein Intermediat bei dieser speziellen Reaktion.
- Uranylacetat
- Illumina-Mitglied
- Beiträge: 1221
- Registriert: Sonntag 8. August 2010, 23:17
- Wohnort: Berlin-Pankow
Diese Variation des Nachweises von Glucose und anderer reduzierender Zucker kenne ich auch unter dem Namen "Trommersche Probe". Hierbei verzichtet man auf die Zugabe eines Komplexbildners. Zunächst gibt man eine zusatzfreie Lösung von Kupfer(II)-salz zu und vermischt. Dann erst sorgt man für die Alkalinität der Mischung. Hierbei wirken die reduzierenden Zucker wegen ihrer vielen OH-Gruppen als Komplexbildner.
Eilhard Mitscherlich (1794 - 1863) entdeckte u. a. die Spaltung von Rohrzucker im Glucose und Fructose. Er wendete die Trommersche und Fehlingsche Probe zur Unterscheidung von Kohlehydraten an.
Eilhard Mitscherlich (1794 - 1863) entdeckte u. a. die Spaltung von Rohrzucker im Glucose und Fructose. Er wendete die Trommersche und Fehlingsche Probe zur Unterscheidung von Kohlehydraten an.
"Der einfachste Versuch, den man selbst gemacht hat, ist besser als der schönste, den man nur sieht." (Michael Faraday 1791-1867)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
Unterstell mir nicht noch einmal, es wäre mir primär darum gegangen, dass Kupfer(I)hydroxid definitiv nicht existiert. Das ist eine blanke Lüge.Klar hattest du auch das kritisiert, worum es dir jetzt angeblich geht. Der Punkt ist auch richtig, aber wirklich nicht dramatisch.
Ich habe nie gesagt, dass mir das wichtig ist, ich habe das in spekulativer form geschrieben "tritt wohl nicht auf" und "bezweifle fast". Eben weil diese Verbindung so krass instabil ist und das viel mehr als Kupfer(II)hydroxid, welches gut charakterisierbar ist.
Professor Blume nehme ich da auch nicht ernst. Er hat 2010 von ausfallendem Kupfer(I)hydroxid geschrieben, aber Soroka beschreibt 2013 noch Kupfer(I)hydroxid als "unknown" und bezieht sich auf ihren Kollegen Korzhavyi, der dessen Existenz in fester Form erst 2012 vorhergesagt hat.
"Nicht alles, was man bei einer Googelsuche im Netz findet, muss auch wahr sein. Man sollte immer kritisch hinterfragen, wer das geschrieben hat und wann." - Immanuel Kant (1759)
Wenn die Menschen und die Dschinn sich zusammentäten, etwas, das diesem Post gleicht, zustande zu bringen, würde ihnen das nicht gelingen – selbst wenn sie einander helfen würden.
Es wäre eine blanke Lüge. Wenn ich das geschrieben hätte. Wenn es dir nicht auch darum gegangen wäre, hättest du dir deinen kleinen Shitstorm sparen können. Eine "Kritik", die den anderen praktisch als Versager und Nichtskönner aussehen lässt und sich zur Hälfte auf die eigene Unwissenheit stützt ("spekulative Form"), ist ein Witz.
Prof. Blume ist eine legitime Quelle für Schüler. Alleine das ist der Punkt. Bariumdisulfat hat diese oder ähnliche Quellen benutzt und dann darf er das auch schreiben. Nochmal: er muss nicht professioneller sein als Professor Blume. Und genau aus diesem Grund ist das Fakezitat hier komplett fehl am Platze. Es sei denn, du änderst zum x-ten Mal deine Richtung und willst wieder, dass er seine Erklärung mit englischsprachiger Primärliteratur absichert.
Beim Abstract hast du falsch gelesen. Korzhavyi hat nicht die Existenz von CuOH vorhergesagt, sondern seine Instabilität. Korzhavyi schreibt in seinem Artikel von "unbekanntem CuOH" im Sinne eines isolierbaren Feststoffs, den man braucht, um die Struktur zweifelsfrei aufzuklären. Die Existenz von CuOH wurde schon viel länger vorhergesagt und ist keine Erfindung von Prof. Blume -> klick.
Um mal wieder zum Thema zu kommen: da Uranylacetat gezeigt hat, dass es sich um keine moderne Variation handelt, wäre die alte Bezeichnung "Trommersche Probe" auch als Artikelüberschrift besser geeignet. Außerdem erhöht das die Legitimation zur Veröffentlichung des Versuchs. Denn sone Art "Namensreaktion" ist es immer wert, gezeigt zu werden.
Prof. Blume ist eine legitime Quelle für Schüler. Alleine das ist der Punkt. Bariumdisulfat hat diese oder ähnliche Quellen benutzt und dann darf er das auch schreiben. Nochmal: er muss nicht professioneller sein als Professor Blume. Und genau aus diesem Grund ist das Fakezitat hier komplett fehl am Platze. Es sei denn, du änderst zum x-ten Mal deine Richtung und willst wieder, dass er seine Erklärung mit englischsprachiger Primärliteratur absichert.
Beim Abstract hast du falsch gelesen. Korzhavyi hat nicht die Existenz von CuOH vorhergesagt, sondern seine Instabilität. Korzhavyi schreibt in seinem Artikel von "unbekanntem CuOH" im Sinne eines isolierbaren Feststoffs, den man braucht, um die Struktur zweifelsfrei aufzuklären. Die Existenz von CuOH wurde schon viel länger vorhergesagt und ist keine Erfindung von Prof. Blume -> klick.
Um mal wieder zum Thema zu kommen: da Uranylacetat gezeigt hat, dass es sich um keine moderne Variation handelt, wäre die alte Bezeichnung "Trommersche Probe" auch als Artikelüberschrift besser geeignet. Außerdem erhöht das die Legitimation zur Veröffentlichung des Versuchs. Denn sone Art "Namensreaktion" ist es immer wert, gezeigt zu werden.
- Uranylacetat
- Illumina-Mitglied
- Beiträge: 1221
- Registriert: Sonntag 8. August 2010, 23:17
- Wohnort: Berlin-Pankow
Gute Idee!Pok hat geschrieben: Um mal wieder zum Thema zu kommen: da Uranylacetat gezeigt hat, dass es sich um keine moderne Variation handelt, wäre die alte Bezeichnung "Trommersche Probe" auch als Artikelüberschrift besser geeignet. Außerdem erhöht das die Legitimation zur Veröffentlichung des Versuchs. Denn sone Art "Namensreaktion" ist es immer wert, gezeigt zu werden.
Hier noch ein Link zu Carl August Trommer .... Wie NI2 schon schrieb, sind die Reaktion und ihre "farbigen Abläufe" gar nicht so banal, wie auch das folgende Studenten Referat zeigt: Kohlenhydrate - Versuchsbeschreibungen . Die Trommersche Probe von 1841 wurde von Hermann Fehling 1848 verbessert.
"Der einfachste Versuch, den man selbst gemacht hat, ist besser als der schönste, den man nur sieht." (Michael Faraday 1791-1867)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
Zunächst einmal Danke an Uranylacetat, dafür, dass Du diese Reaktion als Trommersche Probe identifiziert hast (hätte ich eigentlich auch drauf kommen müssen...  ). Es handelt sich also nicht um eine "zum schlechteren modifizierte Fehlingsche Probe" sondern umgekehrt: die Fehlingsche Lösung ist eine Weiterentwicklung der Trommerschen Reaktion!
). Es handelt sich also nicht um eine "zum schlechteren modifizierte Fehlingsche Probe" sondern umgekehrt: die Fehlingsche Lösung ist eine Weiterentwicklung der Trommerschen Reaktion!
@ Bariumdisulfat: du solltest folgendes verbessern:
1. als Titel die Namensreaktion verwenden
2. die Versuchsdurchführung. Du hast schon festgestellt, daß durch die Lösungsweärme bei Zugabe des NaOH die Reaktion teilweise ausgelöst wird. Abhilfe: gib statt fester NaOH eine konzentierte Lösung von NaOH zu. Tropfenweise, bis die tiefblaue Färbung eintritt, oder immer die gleiche Menge (geschätzt 1 ml zu 10 ml 5 %iger Kupfersulfatlösung + Zucker).
3. Die Erklärung ist teilweise missververständlich bis falsch. Ob nun falsch oder missverständlich - darüber dürfen sich Xyrofl und 'Pok streiten - ist egal. Eine Versuchserklärung muss unmissverständlich sein. Also bitte korrigieren.
Die ganzen Feinheiten (wie einzelne Zucker reagieren und warum oder warum nicht mit alpha- oder betaständigen freien oder gebundenen OH-Gruppen) musst du dagegen nicht einzeln erklären. Eine einfache Erklärung reicht. Aber die muss unmissverständlich und korrekt sein.
4. Die Fotos müssen scharf sein!
 - vielleicht aber auch nicht. Ausprobieren!
- vielleicht aber auch nicht. Ausprobieren!
@ Bariumdisulfat: du solltest folgendes verbessern:
1. als Titel die Namensreaktion verwenden
2. die Versuchsdurchführung. Du hast schon festgestellt, daß durch die Lösungsweärme bei Zugabe des NaOH die Reaktion teilweise ausgelöst wird. Abhilfe: gib statt fester NaOH eine konzentierte Lösung von NaOH zu. Tropfenweise, bis die tiefblaue Färbung eintritt, oder immer die gleiche Menge (geschätzt 1 ml zu 10 ml 5 %iger Kupfersulfatlösung + Zucker).
3. Die Erklärung ist teilweise missververständlich bis falsch. Ob nun falsch oder missverständlich - darüber dürfen sich Xyrofl und 'Pok streiten - ist egal. Eine Versuchserklärung muss unmissverständlich sein. Also bitte korrigieren.
Die ganzen Feinheiten (wie einzelne Zucker reagieren und warum oder warum nicht mit alpha- oder betaständigen freien oder gebundenen OH-Gruppen) musst du dagegen nicht einzeln erklären. Eine einfache Erklärung reicht. Aber die muss unmissverständlich und korrekt sein.
4. Die Fotos müssen scharf sein!
Xyrolfl hat Recht, aber der Gegensatz den er hier angibt stimmt vermutlich nicht. Reaktionen laufen in der Hitze schneller ab als bei Zimmertemperatur. Das ist allgemein so und gilt sowohl für die Reduktion des Kupfer(II) zu Kupfer(I), als auch den Zerfall des Kupfer(I)hydroxids zu Kupfer(I)oxid und Wasser. Aber ... tritt die Reduktion des Kupfer(II) bei längerem Stehenlassen vielleicht auch schon in der Kälte ein? Vielleicht kannst du das einfach mal ausprobieren. Was für Farbänderungen treten auf und wie schnell? (öfter nachsehen und protokollieren!) Vielleicht entsteht ja ein gelber Niederschlag statt des Roten, das wäre dann Kupfer(I)hydroxid...Xyrofl hat geschrieben:Worum es mir ging, war die ganze Zeit die völlige Verdrehung der Verhältnisse in seiner Erklärung. Nicht die Zersetzung des Kupfer(I)hydroxides ist langsam und erfordert Hitze, sondern die Redoxreaktion mit der Glukose.
"Alles sollte so einfach wie möglich gemacht werden. Aber nicht einfacher." (A. Einstein 1871 - 1955)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)
- Uranylacetat
- Illumina-Mitglied
- Beiträge: 1221
- Registriert: Sonntag 8. August 2010, 23:17
- Wohnort: Berlin-Pankow
Übrigens So trivial sind "Trommer" und "Fehling" nicht - zumindestens wenn es um den qualitativ/quantitativen Nachweis einer Glykosurie im Harn geht, wie folgendes PDF zeigt:
Vergleichende Untersuchungen über den Wert der AIménschen Wismutprobe und der Worm Müillerschen Kupferprobe bei der Untersuchung des Harnes auf Zucker
@Bariumdisulfat, ich möchte nur zeigen, wie komplex dieses interessante Thema ist...
Vergleichende Untersuchungen über den Wert der AIménschen Wismutprobe und der Worm Müillerschen Kupferprobe bei der Untersuchung des Harnes auf Zucker
@Bariumdisulfat, ich möchte nur zeigen, wie komplex dieses interessante Thema ist...
"Der einfachste Versuch, den man selbst gemacht hat, ist besser als der schönste, den man nur sieht." (Michael Faraday 1791-1867)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
Das ist ein wunderbarer link! Danke! Ich liebe es solche Artikel (welche Zeitschrift übrigens?) bequem im Sessel zurückgelehnt zu lesen und mir vorzustellen wie damals um diese Aussagen gestritten wurde. Auch die Diskussion um die Namensgebung ist notorisch! Ich kenne die "Wismutprobe" nur unter dem Namen Nylanders. Und wer zum Kuckuck war "Worm Müller"? Sein Reganz ist ja gleich zusammengestezt wie Fehlings Reagenz....
Entgegen dem, was in dem Artikel gesagt wird, ist Gluckose im Urin bei nicht-zuckerkranken Menschen praktisch nie nachzuweisen (es gibt sehr seltene Fälle einer angeboren erniedrigten Gluoseschwelle der Nieren). Mit den heutigen enzymatischen Nachweismethoden ist das ganz eindeutig. Die häufigen positiven Proben damals müssen auf anderen Bestandteilen beruht haben. Hammarsten hat also nicht so unrecht, wenn er meint, daß eine Reduktionsprobe, um praktisch brauchbar zu sein, nicht zu empfindlich sein darf.
Die Nieren haben eine "Glukoseschwelle" (die heißt tatsächlich so). Aus dem Primärharn wird Glukose nämlich bis zu einer bestimmten Menge vollständig zurückresorbiert und wieder dem Blut zugeführt. Glukose im Urin auszuscheiden, wäre für den Körper ja ein Verlust. Erst wenn der Blutzucker die "Schwelle" von ca. 180 mg/dl überschreitet, wird die Resorptionskapazität überschritten und es wird Glukose im Urin nachweisbar. Vor der Entdeckung des Insulins glaubte man, die Zuckerkrankheit sei eine Nierenkrankheit und der Tod der Patienten komme dadurch zustande, daß "lebenswichtige Stoffe wie Zucker" mit dem Urin verloren gingen.
Entgegen dem, was in dem Artikel gesagt wird, ist Gluckose im Urin bei nicht-zuckerkranken Menschen praktisch nie nachzuweisen (es gibt sehr seltene Fälle einer angeboren erniedrigten Gluoseschwelle der Nieren). Mit den heutigen enzymatischen Nachweismethoden ist das ganz eindeutig. Die häufigen positiven Proben damals müssen auf anderen Bestandteilen beruht haben. Hammarsten hat also nicht so unrecht, wenn er meint, daß eine Reduktionsprobe, um praktisch brauchbar zu sein, nicht zu empfindlich sein darf.
Die Nieren haben eine "Glukoseschwelle" (die heißt tatsächlich so). Aus dem Primärharn wird Glukose nämlich bis zu einer bestimmten Menge vollständig zurückresorbiert und wieder dem Blut zugeführt. Glukose im Urin auszuscheiden, wäre für den Körper ja ein Verlust. Erst wenn der Blutzucker die "Schwelle" von ca. 180 mg/dl überschreitet, wird die Resorptionskapazität überschritten und es wird Glukose im Urin nachweisbar. Vor der Entdeckung des Insulins glaubte man, die Zuckerkrankheit sei eine Nierenkrankheit und der Tod der Patienten komme dadurch zustande, daß "lebenswichtige Stoffe wie Zucker" mit dem Urin verloren gingen.
"Alles sollte so einfach wie möglich gemacht werden. Aber nicht einfacher." (A. Einstein 1871 - 1955)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)
- Uranylacetat
- Illumina-Mitglied
- Beiträge: 1221
- Registriert: Sonntag 8. August 2010, 23:17
- Wohnort: Berlin-Pankow
Hallo lemmi,
so dachte ich auch, als ich den Artikel las....
Übrigens bringt ARTE am Montag, den 06.06. um 17:30 Uhr Die besondere Wissenschaft vom Urin
so dachte ich auch, als ich den Artikel las....
Übrigens bringt ARTE am Montag, den 06.06. um 17:30 Uhr Die besondere Wissenschaft vom Urin
"Der einfachste Versuch, den man selbst gemacht hat, ist besser als der schönste, den man nur sieht." (Michael Faraday 1791-1867)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
Alles ist Chemie, sofern man es nur "probiret". (Johann Wolfgang von Goethe 1749-1832)
„Dosis sola facit venenum.“ (Theophrastus Bombastus von Hohenheim, genannt Paracelsus 1493-1541)
"Wenn man es nur versucht, so geht´s; das heißt mitunter, doch nicht stets." (Wilhelm Busch 1832 -1908)
- frankie
- Illum.-Ass.
- Beiträge: 1941
- Registriert: Dienstag 10. April 2007, 17:00
- Wohnort: Res Publica Austria
Eine aktuelle Publikation zu dem Thema ist im EurJIC als "The Species of Fehling's Solution" zu finden unter doi:10.1002/ejic.201600168 oder hier.
It is always better to have no ideas than false ones; to believe nothing, than to believe what is wrong.
(Thomas Jefferson)
(Thomas Jefferson)
Das ist wirklich "komplexe" Chemie! Und was für eine umständliche Weise Kupfer(II)-hydroxid darzustellen! Warum der Umweg, erst mit Ammoniak und dann mit NaOH zu fällen?
"Alles sollte so einfach wie möglich gemacht werden. Aber nicht einfacher." (A. Einstein 1871 - 1955)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)