Kommt zwar selten vor, aber manchmal ist eben nicht das drin, was draufsteht. Ganz eindeutig bei diesem Gebinde:

Dimethylaminobenzaldehyd ist alles, aber nicht quietschorange. Da muss ein Fehler beim Befüllen passiert sein, vermutlich nicht beim Hersteller, sondern danach in der Apotheke. Es handelt sich um eine Reagenzienflasche von Merck zum DAB 7. Das legt es nahe, mal dort nachzuschlagen, welche Reagenzien noch mit "Dimethylamino" anfangen und zu der Verwechslung geführt haben können. Eigentlich findet sich nur ein Kandidat : p-Dimethylamino-azobenzol oder Methylgelb. Das ist ein lipophiler Indikator der im sauren rot und im neutralen bzw basischen gelb gefärbt ist.
Die ersten Tests scheinen in diese Richtung zu weisen. Dis Susbtanz löst sich gar nicht in Wasser und nur mäßig in Ethanol von 96%. Die ethanolische Lösung färbt sich in verdünnter Salzsäure tiefrot, in Natronlauge gelb und es tritt eine Trübung auf, weil sich der Farbstoff wieder ausscheidet.

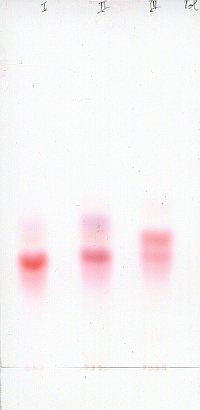
Methylrot und Methylorange sind auch Dimethylaminoazobenzolabkömmlinge, allerdings ist ersteres als Feststoff tiefrot gefärbt und letzteres gut wasserlöslich. Hier habe ich Lösungen der drei Indikatoren und meiner Probe (ganz links) in Hydrogenphtalatpuffer von pH 4 gegeben:

Der Verdacht scheint sich zu verdichten. Die Färbung meiner Probe passt noch am ehesten zum Methylgelb, wenn sie auch nicht ganz gleich ist.
Dann habe ich DCs gemacht. Als Vergleichslösung hatte ich aber nur eine ältere Dimethylgelb-LÖösung (in Ethanol) zur Verfügung.
Hier die DC mit Dichlormethan als Laufmittel:

Von links nach rechts: Probelösung - Dimethylgelblösung - Methylrotlösung - Phenolrotlösung - MethylorangelösungPhenolrot und Methylorange laufen als hydrophile Stoffe gar nicht. Lustig ist das Methylrot, das zweimal zwei verschieden gefärbte Spots liefert. Vermutlich liegt eine Verunreinigung vor (schwache Zonen unter den jeweiligen Hauptzonen) und die unteren, roten Flecken sind einfach die protonierte Form der jeweiligen Substanzen.
Aber störend ist, daß der Rf-Wert meiner Probe nicht ganz mit der des Dimethylgelbs übereinstimmt! Also habe ich die DC wiederholt, diesmal mit Toluol als Laufmittel (v.l.n.R.: Dimethylgelblösung - Probelösung - Methylrotlösung)
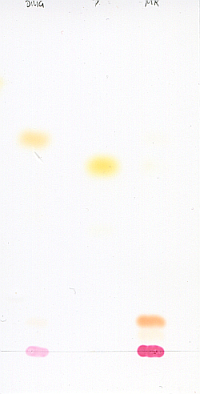
Das Methylrot läuft fast gar nicht. Aber das Dimethylgelb läuft wieder auf einer deutlich anderen Höhe als meine Probensubstanz.
Was muss ich daraus folgern? Offenbar ist mein Kandidat doch kein Dimethylgelb - oder gibt es für das abweichende Verhalten in der DC eine andere Erklärung? Was könnte es sonst sein?