xD

Gefällt mir im Großen und Ganzen.

Bei der Bromierung des Acetanilids dirigiert die Aminogruppe in ortho und para-Stellung, nur würde ich behaupten, dass die o-Position sterisch durch die Acetylgruppe etwas behindert ist. Deshalb erhältst Du vorwiegend das p-Produkt.
Aus diesem Grunde kann deine Acetylgruppe auch nicht wirklich als Schutzgruppe für die Aminogruppe agieren, sonst würdest du im folgenden Schritt ja auch die Aminogruppe bromieren, was jedoch nicht der Fall ist. Der Stickstoff schiebt nämlich seine Elektronen schön in den Ring und erhöht damit die Elektronendichte (+I/M-Effekt).
Und bei der Verkochung entzieht das Phenylkation dem Ethanol keineswegs ein Hydridion. Der Wasserstoff ist gar nicht in der Lage dem Sauerstoff das Elektronenpaar abzuknöpfen.

Es handelt sich um eine einfache elektrophile Addition mit anschließender Protonenabspaltung. Zeichne daher den Pfeil auch am besten an den Sauerstoff und nicht an den Wasserstoff.
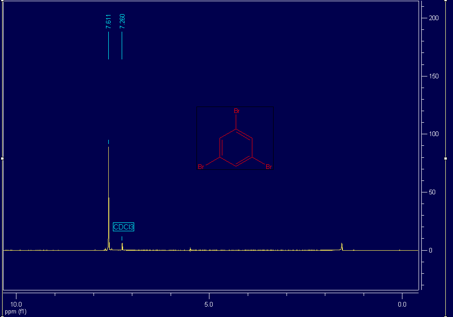
Man könnte doch den Versuch auch wirklich mal in Dioxan durchführen. Damit sollten sich noch bessere Ausbeuten erreichen lassen. Und die Spuren an iodiertem Produkt sollten dann verzeihbar sein. Wenn einmal umkristallisiert wurde, würde ich von einem sehr reinem Produkt reden wollen.