Geräte:
Magnetrührer, Heizbad, Destille, Gasentwickler, Gaseinleitungsrohr, Zweihalskolben, Magnetrührstäbchen, Scheidetrichter
Chemikalien:
Benzol
Trichlorisocyanursäure



Salzsäure
Eisen(III)-chlorid
Chlor
Chlorwasserstoff
Chlorbenzol
Hinweis:
Benzol ist krebserregend und giftig. Auch Chlor ist giftig. Deshalb sollte die komplette Synthese und die Destillation unter dem Abzug stattfinden. Bei der Säuberung der Geräte muß ein Hautkontakt mit den anhaftenden Resten von Benzol, Chlorbenzol und Dichlorbenzol vermiden werden. Am besten reinigt man die Glasgeräte draußen unter Verwendung von Handschuhen.
Durchführung:
In einem Zweihalskolben werden 45 ml Benzol, 2 g Eisen(III)-chlorid und ein Magnetrührstäbchen vorgelegt. Ein Gasentwickler wird mit Trichlorcyanursäure und Salzsäure beschickt und daneben aufgebaut. Auf den Zweihalskolben wird ein Rückflusskühler gesetzt und seitlich durch den zweiten Hals ein Gaseinleitungsohr eingeführt. Ist diese Apparatur aufgebaut, wird der Zweihalskolben in das Wasserbad gestellt und der Gasentwickler durch einen Schlauch mit dem Gaseinleitungsrohr verbunden. Ist dies geschehen, beginnt man das Heizbad auf 90-100 °C aufzuheizen. Wenn das Benzol siedet wird mit dem Einleiten des Chlorgases begonnen. Dies wird solange weiter geführt, bis keine Tropfen mehr über den Kühler zurück fließen (kann bei starken Chlorstrom mindestens 4 Stunden dauern). Wenn der Sumpf abgekühlt ist, gibt man ihn in einen Scheidetrichter und schüttelt ihn zuerst mit Wasser, dann mit Natronlauge und dann wieder mit Wasser aus, um Chlorreste und andere Verunreinigungen zu entfernen. Anschließend wird der Rest über Calciumchlorid einen Tag lang getrocknet. Am nächsten Tag wird der Sumpf mittels Destillation getrennt. Man fängt die zwischen 75-90 °C und 125-140 °C siedenden Fraktionen auf. Aus der ersten Fraktion kann man das Benzol, welches nicht umgesetzt wurde, zurückgewinnen und aus der zweiten kann durch erneute Destillation reines Monochlorbenzol gewonnen werden (darauf habe ich wegen der geringen Ausbeute aber verzichtet). Wenn man das Chlorbenzol nicht weiter aufarbeitet, sollte man ein paar Stücken Calciumchlorid für 1-2 Tage in das Produkt geben, um es vollständig zu trocknen.
Ausbeute: 13,3 ml (27 % d.Th.)
Entsorgung:
Das Benzol wird aufgearbeitet oder in die organischen Abfälle gegeben. Das Monochlorbenzol wird aufbewart oder in die halogenhaltigen Abfälle gegeben. Reste des Sumpfs werden ebenfalls in die halogenhaltigen organischen Abfälle gegeben.
Erklärung:
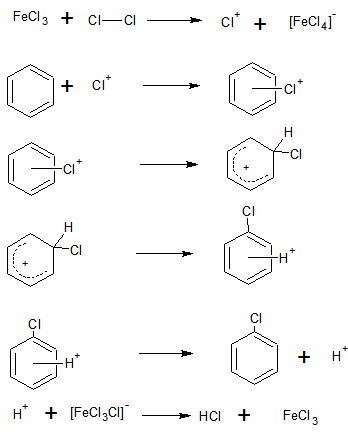
Aromaten gehen meist keine Additionsreaktionen ein, da das 6π-Elektronensystem des Benzols sehr stabil ist. So kommt nur eine elektrophile Substitution in Frage. Der einzuführende Substituent (hier Cl) muss so stark elektrophil sein, dass er in der Lage ist, das Elektronensystem des Benzolringes anzugreifen. Da hierbei das π-Elektronensystem des Benzols gestört werden muss, gelingt dies nur starken elektrophilen Gruppen. Deswegen wird eine Lewis-Säure eingesetzt wird, die zur Bildung des Elektrophils beiträgt, nämlich zur Bildung eines Chloronium-Ions. Dieses Chloronium-Ion ist sehr reaktiv und stark elektrophil. Es greift das Elektronensystem des Benzolringes an und bildet zunächst einen α-Komplex, wobei das Chloronium-Ion nur locker an das Elektronensystem des Benzolringes gebunden ist. Als nächster Schritt lagert sich das Chloronium-Ion an ein Kohlenstoff-Atom des Benzolringes an, wodurch ein sogenanntes Benzenium-Ion (auch als Sigma-Komplex bezeichnet) ensteht, in dem sich die delokalisierte Ladung sich über dem Benzolring befindet. Das enstehende 4π-Elektronensystem ist nicht so stabil wie das 6π-Elektronensystem des Benzols, weswegen ein Proton (H+) abgespalten wird, um das Elektronensystem des Benzols zu ereichen, dabei entsteht Chlorbenzol. Das freigewordene H+ wird von dem zu Anfang gebildeten Anion ([FeCl4]-) aufgenommen, und es bilden sich Chlorwasserstoff und wieder Eisen(III)-chlorid. Das Eisen(III)-chlorid kann in dieser Reaktion als Katalysator angesehen werden, da es unverändert aus der Reaktion hervorgeht und nur zur Bildung des Chloronium-Ions benötigt wird.
Bilder:

Die Apparatur

Kolbeninhalt vor der Reaktion

Sumpf vor der Destillation

Fertiges Produkt