Die von Dennis F. Evans in den 1950er Jahren entwickelte und nach ihm benannte Methode, stellt eine einfache Möglichkeit dar, magnetische Suszeptibilitäten mittels gewöhnlicher Kernresonanzspektroskopie (FT-NMR) zu bestimmen. Die Methode ist in der präparativen anorganischen Chemie weit verbreitet, da sie zur Charakterisierung von paramagnetischen Übergangsmetallverbindungen herangezogen werden kann ohne spezielle Gerätschaften, wie eine Faraday'sche Waage oder ein SQUID Magnetometer, zu benötigen.
Erklärung:
Viele Übergangsmetallverbindungen (Komplexe der d-Elemente) sind elektronisch offenschalige Systeme mit ungepaarten Elektronen. Solche Systeme besitzen einen Gesamtspin S ≠ 0 und demnach ein zugehöriges magnetisches Moment µ. Grundsätzlich ist das magnetische Moment vom Zusammenwirken von Gesamtspin S und Gesamtbahndrehimpuls L abhängig. Kann der Beitrag von L jedoch ignoriert werden oder ist dieser gar nicht vorhanden (L = 0) so beseht nur ein Zusammenhang mit S und daher näherungsweise mit der Zahl ungepaarter Elektronen.
In erster Näherung kann daher das effektive magnetische Moment eines Systems mit ungepaarten Elektronen durch nachstehende Formel berechnet werden. µB steht dabei dabei für das Bohrsche Magneton und stellt eine Einheit für das magnetische Moment dar. N ist die Anzahl ungepaarter Elektronen.
\( \frac{\mu_{eff}}{\mu_{B}} = 2 \cdot \sqrt{S(S+1)} = \sqrt{N(N+2)} \)
Experimentell kann das magnetische Moment über die magnetische Suszeptibilität erhalten werden. Es gilt:
\( \frac{\mu_{eff}}{\mu_{B}} = 2,82 \cdot \sqrt{\chi_{molar} \cdot T}\)
Die molare Suszeptibilität Χmolar wird aus der Evans-Messung erhalten und errechnet sich durch:
\(\chi_{molar} = \frac {3 \cdot \Delta f \cdot V \cdot M_W }{ 4 \cdot \pi \cdot f_0 \cdot m_{Substanz}}\)
Dabei ist Δf die chemische Verschiebung in Hz (ablesbar im NMR Spektrum), MW das Molgewicht der Substanz, mSubstanz die exakte Einwaage, V das exakte Volumen (cm3), T die absolute Temperatur in Kelvin und f0 die Spektrometerfrequenz (abhängig vom Gerät)
Durchführung:
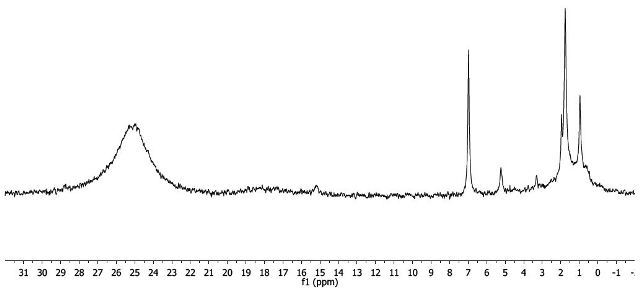
Die Durchführung erfolgt unter Nutzung eines besonderen NMR-Röhrchens mit einsetzbarer Kapillare. Durch diesen Aufbau entsteht ein innerer und ein äußerer Raum der getrennt befüllt werden kann. In die Kapillare wird eine Lösung (Konzentration exakt bekannt !) der Substanz in einem nicht deuterierten Lösungsmittel eingefüllt und in das äußere Röhrchen (Standard NMR-Rohr) eine Mischung aus deuteriertem und nicht deuteriertem Lösungsmittel. Die beiden Teile werden vorsichtig ineinander gesteckt und in einem FT-NMR-Gerät (z.B 250 MHz Routine-Gerät) platziert. Nach standardmäßigem Lösungsmittel-Lock und Shimming wird ein 1H-Spektrum aufgenommen. In diesem Spektrum erscheint nun der Lösungsmittel-Shift (z.B einer Methylgruppe des Acetons) und ein zusätzliches Signal durch die paramagnetische Wechselwirkung. Aus der Verschiebung der beiden Signale lässt sich nun der gewünschte Wert Δf errechnen oder am PC ablesen.
Dies soll anhand des Beispiels Eisenacetylacetonats (Synthese) demonstriert werden: Das Produkt dieser Synthese ist ein roter Feststoff mit der Summenformel Fe(CH3COCHCOCH3)3 und der Molmasse 353.17 g/mol. Weist man dem Eisen die Oxidationsstufe +III zu, so lassen sich dem Metall im Rahmen der Kristallfeldtheorie 5 d-Elektronen zu weisen (elementares Eisen [Ar]3d64s2). Unter Annahme einer oktaedrischen Koordinationsgeometrie stellt sich die Frage ob Fe(acac)3 als Low-Spin oder oder als High-Spin Komplex, daher als Komplex mit einem oder mit fünf ungepaarten Elektronen vorliegt. Die Evans Methode stellt nun eine einfache Möglichkeit dar diese Frage zu beantworten.
Stellt man eine Lösung von z.B. 0,0125 g des Komplexes in 10,0 mL Aceton her und verfährt nach obigem Protokoll so erhält man eine Verschiebung der Methylgruppen-Signale von Δf = 54 Hz. Verwendet man ein Routine 250 MHz Spektrometer (f0 = 250000000 Hz) und misst bei Raumtemperatur von 23 °C (T = 296 K) so errechnet sich aus diesen Werten eine molare Suszeptibilität von 0.01457 cm³ / mol und daraus ein magnetisches Moment µeff = 5.87 µB. Zieht man nun die erste Formel heran so erkennt man, dass fünf ungepaarte Elektronen (N = 5) einem theoretischen Wert von 5.91 entsprechen und ein (N = 1) ungepaartes Elektron einem Wert von 1.73 entspricht. Die Messung zeigt daher, dass Fe(acac)3 ein High-Spin Komplex mit fünf ungepaarten Elektronen ist.
Bei mehrkernigen Komplexen (mit mehr als einem Metallatom pro Molekül) kann es zu kooperativen Effekten (magnetische Kopplung) und daher, wie auch bei schweren d-Elementen, zu abweichenden Ergebnissen kommen. Ferner kann das Ergebnis noch mit Faktoren für diamagnetische Anteile, Lösungsmittel und Dichteunterschiede korrigiert werden.
Bilder:
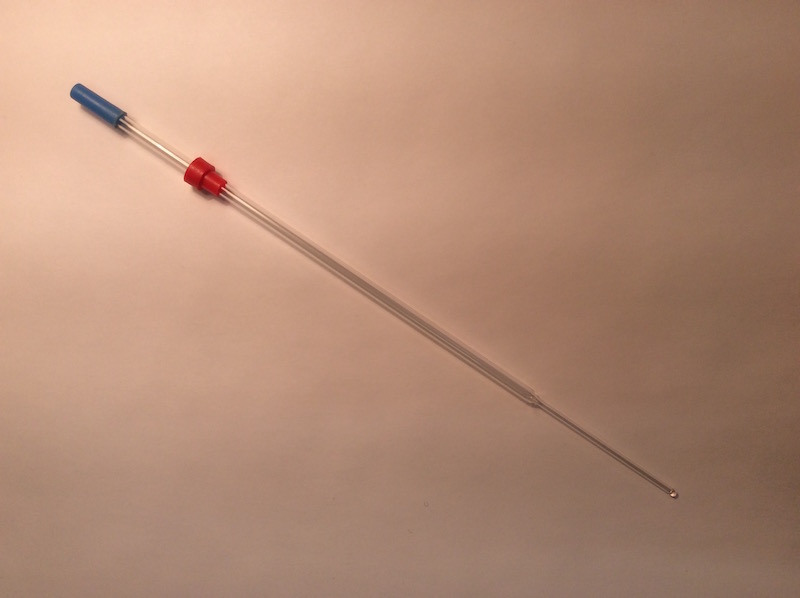
Evans-NMR-Rohr mit Kapillare

Befülltes und einsatzbereites NMR-Rohr
Literatur:
[1] J. Chem. Soc., 1959, 2003-2005
[2] J. Chem. Educ., 1972, 49 (12), p 829
[3] J. Chem. Educ., 1992, 69 (1), p 62