Diese Reaktion läuft bei nucleophilen Substitutionen an primären Aliphaten ab. Es ist eine bimolekulare Reaktion (Reaktion 2.Ordung).
Als Beispiel soll hier die Verseifung von Methylbromid dienen. Halogenierungen von primären Alkoholen sind auch Nucleophile Substitutionen. Da OH- aber eine schlechte Abgangsgruppe ist, wird durch Säurezusatz erst protoniert, dann Wasser eliminiert.
Benannt nach: entfällt
Entdeckung: entfällt
Mechanismus:
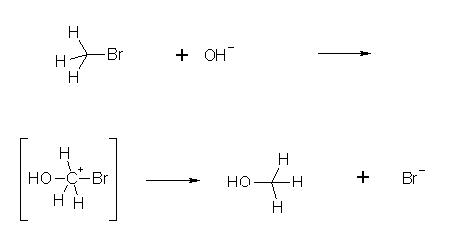
Das nucleophile Hydroxidion, eine stärkere Lewis-Base als das Bromidion, greift das Brommethan an der zum Brom gegenüberliegenden Seite an. Dabei bildet sich eine kovalente O-C Bindung,
wobei die C-Br Bindung geschwächt wird. Intermediär sind beide Nucleophile an das (nun sp2 hybridisierte) Kohlenstoffatom partiell gebunden.
Unter Eliminierung des Broms tritt eine Invertierung der Wasserstoff ein, da das Kohlenstoffatom wieder in die sp3-Konfiguration übergeht. Diese Umkehrung wird als Walden'sche Umkehrung bezeichnet. Da diese Reaktion bimolekular abläuft, unterliegt sie dem Geschwindigkeitsgesetz der 2. Ordnung (daher auch der Name).
Beispiele für Nucleophile Substitutionen:
Darstellung von Ethylbromid
Darstellung von Methyliodid über die Phosphorhalogenide. Iod als solches müsste erst heterolytisch gespalten werden um nucleophile Substitutionen eingehen zu können.