Eine nucleophile Substitution dient generell dazu, eine funktionelle Gruppe, oder einen Wasserstoff durch eine andere funktionelle Gruppe zu ersetzen.
Das angreifende Nucleophil (kernliebendes Teilchen) ist negativ geladen oder neutral mit freiem Elektronenpaar. Der folgende SN1 Mechanismus läuft an tertiären Kohlenstoffatomen ab. Primäre Kohlenstoffatome bevorzugen Substitution per SN2. Bei sekundären Kohlenwasserstoffen läuft meist eine Mischung aus uni- und bimolekularer nucleophiler Substitution ab.
Benannt nach: entfällt
Entdeckung: entfällt
Mechanismus:
Als Beispiel die Verseifung von t-Butylchlorid (2-methyl-2-Chlorpropan):
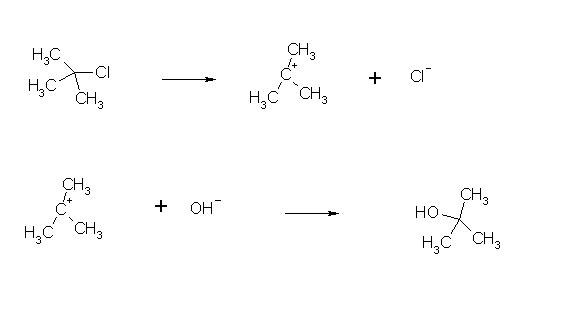
In einer heterolytischen Spaltung, bildet sich im ersten Reaktionsschritt ein sehr stabiles tertiäres Carbeniumion (hier Trimethylcarbeniumion) und ein Chloridion, hierbei geht das Kohlenstoffatom von der sp3-Hybridisierung in eine sp2-Hybridisierte Form über, da das Chloridion ein Elektron behält. So kann ein Elektron weniger an der Orbitalhybridisierung teilnehmen, das benannte Carbeniumion ist sterisch planar. Vorher konnte das Nucleophil nicht angreifen, da durch die Methylgruppen eine sterische Hinderung bestand, jedoch kann es nun von zwei verschiedenen Seiten an das tertiäre Carbeniumion angreifen, wobei chirale Verbindungen entstehen, was aber nur bei chiralen Ausgangsverbindungen der Fall sein kann. Hier entsteht ein Racemat, also ein Stoffgemisch, welches nach außen optisch inaktiv ist, da es genau die gleichen Anteile des links- und rechtsdrehenden Isomers enthält. In Nebenreaktionen kann sich z.B. das oben benannte Hydroxidion an einen der Wasserstoffe in den Methylgruppen des tert.-butyl-Kations anlagern, wobei unter Wassereliminierung 2-Methylpropen entsteht. Neben Eliminierungen können auch Umlagerungen als Nebenreaktion vorkommen.
Eine Steuerung dieser Reaktion ist über die Solvatation möglich. Die Wasserstoffbrückenbindung von polaren, protischen Lösungsmitteln hemmen die Nucleophilie der Nucleophilen. Polare, aprotische Lösungsmittel dagegen, beschleunigen durch Solvatation der Nucleophilen die Reaktion.
In 50%igen Ethanol läuft die Reaktion 30.000 mal schneller ab als in reinem Wasser. (Quelle: Sykes, Reaktionsmechanismen, nucleophile Substitution an Aliphaten)
