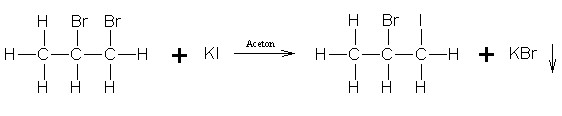
Die Finkelstein Reaktion ist eine Umhalogenierung eines Alkylhalogenids mit einem Alkalihalogenid.
Sie wird oft zur Darstellung von Alkyliodiden aus den entsprechenden Alkylchloriden/-bromiden und Alkaliiodid in Aceton genutzt.
Benannt nach: Hans Finkelstein (D)
Entdeckung: 1910
Mechanismus:
Bei der nach einem SN2-Mechanismus verlaufenden Reaktion wird ein Alkylhalogenid mit einem Alkalihalogenid als Nukleophil umgesetzt.
Im Gegensatz zu den gut löslichen Alkaliiodiden sind die Alkalichloride/-bromide in Aceton unlöslich und fallen als Niederschlag aus.
So wird das Gleichgewicht der Reaktion auf die Seite der thermodynamisch weniger stabilen Alkyliodide verschoben.

Aus sterischen Gründen reagieren primäre Alkylhalogenide gut, sekundäre und tertiäre Alkylhalogenide dagegen nur schlecht nach der Finkelstein-Reaktion.
Dies kann dazu genutzt werden Dialkylhalogenide mit primär und sekundär/tertiär gebundenem Halogen selektiv umzuhalogenieren.