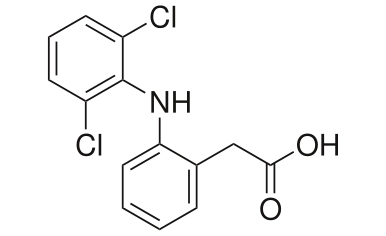
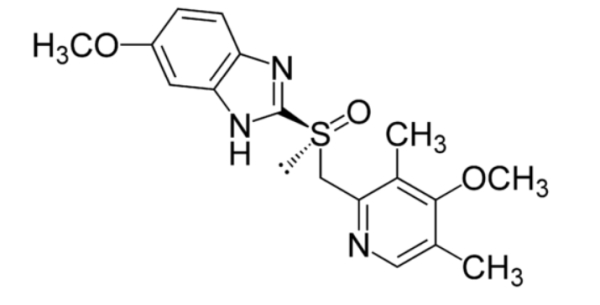
Nochmal eine Frage zur Acidität/Alkalinität einer Verbindung!
Folgende Substanz wird unter dem INN Chlorphenamin als Antihistaminikum (ein ziemlich altes) verwendet:
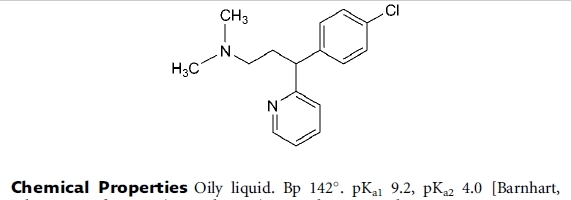
Ich interpretiere die Angaben so: das Molekül hat zwei N-Atome, die protoniert werden können. Ich vermute, der aliphatisch gebundene N ist stärker basisch als der Pyridinstickstoff. Richtig?
Der erste pKa ist 9,2, das heißt der korrespondierende pKb wäre 4,8, nicht wahr? Damit ist der aliphatische Stickstoff ungefähr so basisch wie Ammoniak (pKb 4,76).
Der zweite pKa ist 4,0, der korrespondierende pKb damit 10. Das ist eine extrem schwache Base, so etwa wie Noscapin (pKb 10,7). Richtig?
Ich würde also erwarten, dass die Substanz auch in leicht saurem Medium noch stabile Salze bildet, d.h. in ionisierter Form vorliegt und sich nicht in unpolare Lömi ausschütteln lässt. Im alkalischen Medium müsste es ausschüttelbar sein.
Jetzt kommt meine Frage:
Kann Chlorphenamin in stark basischem Medium irgendwie ein Anion bilden? Paracetamol (siehe oben) ist ein Phenol mit einem pKa von 9,5 und bildet in stark alkalischem Medium ein Phenolat-Anion. Allerdings wüsste ich nicht wie das bei der Struktur des Chlorpheniramins möglich sein sollte. Pyridin bildet ja auch keine Anionen.
"Alles sollte so einfach wie möglich gemacht werden. Aber nicht einfacher." (A. Einstein 1871 - 1955)
"Wer nur Chemie versteht, versteht auch die nicht recht!" (G.C. Lichtenberg, 1742 - 1799)
"Die gefährlichste Weltanschauung ist die Weltanschauung der Leute, die die Welt nie gesehen haben." (Alexander v. Humboldt, 1769 - 1859)