Ich will sogenannte COX-2-Hemmer nachweisen. Das ist eine Gruppe von Arzneistoffen, die entzündungshemmend wirken und u.A. bei Schmerzen im Sekelettsystem verwendet werden.
Typische Vertreter sind die folgenden:

Celecoxib

Etoricoxib

Rofecoxib
In der Pharmazie verwendet man den Stas-Otto-Trennungsgang, um aus einer Arzneizubereitung die Arzneistoffe zu isolieren. Dabei handelt es sich um serielle Extraktionen aus wässriger Lösung mit Hilfe verschiedener Lösungsmittel (vor allem Ether und MIBK) bei verschiedenen pH-Werten.
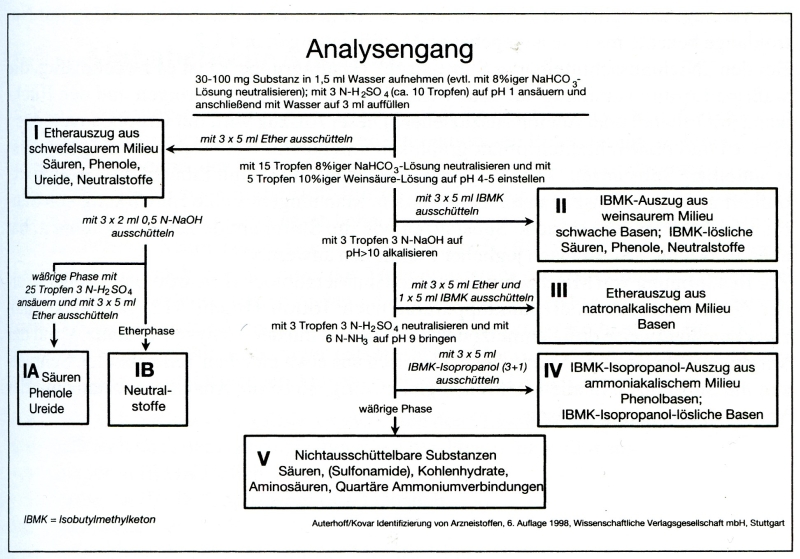
Meine Frage - zu der ich keine Informationen gefunden habe - ist: in welcher Fraktion habe ich die oben gezeigten Substanzen zu erwarten? Würden sie sich eher als Säuren oder als Basen verhalten? Oder gar als Neutralstoffe, die in der wässrigen Lösung verbleiben und mit organischen Lösungsmitteln nicht (oder kaum) auszuschütteln sind? Könnt ihr mir helfen, die Säure/Basenstärke der Substanzen abzuschätzen?
