Nächste Aufgabe?
Retrosynthese
Moderator: Moderatoren
- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Die wunderschöne [4+2] ^^
Ich überleg mir was
Fertig Überlegt^^
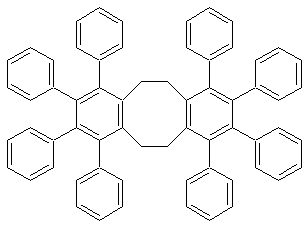
aus 1,5-COD
Ist was für Dich^^ solltest du eigentlich hinbekommen
[Wollte eigentlich was andere nehmen, aber das würde ja mein nächstes Projekt verraten]
Ich überleg mir was
Fertig Überlegt^^

aus 1,5-COD
Ist was für Dich^^ solltest du eigentlich hinbekommen
[Wollte eigentlich was andere nehmen, aber das würde ja mein nächstes Projekt verraten]
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
5,6,11,12-Tetrahydro-1,2,3,4,7,8,9,10-octaphenyldibenzo[a,e]cycloocten (10)
1,5-COD 1 bromieren 2 und (mit KOtBu in THF bei -78 bis -65 °C) zum Olefin 3a, 3b überführen. Ohne die Isomere zu trennen (mit KOtBu und [18]Krone-6 in Pentan bei 36 °C) erneut HBr eliminieren 4.
Tetraphenylcyclopentadienon (TPCP) 7 aus 1,3-Diphenylaceton 5 und Benzil 6 darstellen (oder kaufen) und mit dem 1-bromcyclooct-1-en-5-yn 4 unter Abspaltung von CO zu 8 umsetzen. Erneut (mit KOtBu und [18]Krone-6) HBr eliminieren 9 und mit TPCP zu 10 umsetzen.
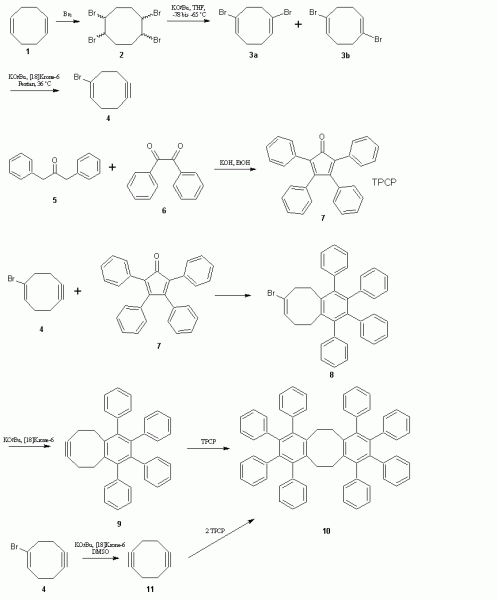
Alternativ kann man das 1-bromcyclooct-1-en-5-yn 4 auch (mit KOtBu in DMSO) zum 1,5-Cyclooctadiyn 11 (geringe Ausbeute, schlecht zu isolieren, aber bessere Produktausbeute von 10) umsetzen und mit 2 mol TPCP direkt zum Produkt reagieren lassen.
Nächstes:
aus Phenol oder Chlorbenzol.
1,5-COD 1 bromieren 2 und (mit KOtBu in THF bei -78 bis -65 °C) zum Olefin 3a, 3b überführen. Ohne die Isomere zu trennen (mit KOtBu und [18]Krone-6 in Pentan bei 36 °C) erneut HBr eliminieren 4.
Tetraphenylcyclopentadienon (TPCP) 7 aus 1,3-Diphenylaceton 5 und Benzil 6 darstellen (oder kaufen) und mit dem 1-bromcyclooct-1-en-5-yn 4 unter Abspaltung von CO zu 8 umsetzen. Erneut (mit KOtBu und [18]Krone-6) HBr eliminieren 9 und mit TPCP zu 10 umsetzen.

Alternativ kann man das 1-bromcyclooct-1-en-5-yn 4 auch (mit KOtBu in DMSO) zum 1,5-Cyclooctadiyn 11 (geringe Ausbeute, schlecht zu isolieren, aber bessere Produktausbeute von 10) umsetzen und mit 2 mol TPCP direkt zum Produkt reagieren lassen.
Nächstes:

aus Phenol oder Chlorbenzol.
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Nicht ganz
Deswegen dachte ich aber auch, dass du das ganze recht fix gelöst bekommst
EDIT: Nachgerechnet braucht man pro 100 mg 10 so in etwa 20 g. Allerdings hantiert man dann zwischenzeitlich mit Produktmengen von 50 mg, was bei Flüssigkeiten (Ölen) keinen Spaß/Sinn mehr macht, da KOtBu für's Hobbylabor doch relativ teuer ist.
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Hätte ich vllt. dieses Wochenende. Unter der Woche sieht's bei mir gerade zeitlich gaaaanz schlecht aus. 
 Dass da TPCP verwendet wird dachte ich mir schon, weiter habe ich dann aber nicht drüber nachgedacht. Obwohl es natürlich jetzt im Nachhinein betrachtet von dort aus ein Kinderspiel ist.
Dass da TPCP verwendet wird dachte ich mir schon, weiter habe ich dann aber nicht drüber nachgedacht. Obwohl es natürlich jetzt im Nachhinein betrachtet von dort aus ein Kinderspiel ist. 
"It is arguably true that the tetrapyrrole system is Nature's most remarkable creation."
- Claude Rimington
- Claude Rimington
Mist - dann hätte ich noch das WE abwarten sollen. Naja ich dachte mir nur, dass es nicht wieder so lange 'rumgammelt', löse ich's einfach mal.
Ich finde der Knackpunkt, ist draufzukommen, dass bei den (hier benötigten) tiefen Temperaturen das Alkin gebildet werden und die Tetradehydrobromierung nicht zwangsläufig zum COT führt, sondern auch zum 1,5-Cyclooctadiin (1,5-Cyclooctadiyn) gerichtet werden kann.
Das Aktuelle ist recht fix zu machen
Ich finde der Knackpunkt, ist draufzukommen, dass bei den (hier benötigten) tiefen Temperaturen das Alkin gebildet werden und die Tetradehydrobromierung nicht zwangsläufig zum COT führt, sondern auch zum 1,5-Cyclooctadiin (1,5-Cyclooctadiyn) gerichtet werden kann.
Das Aktuelle ist recht fix zu machen
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
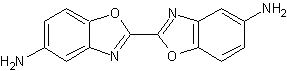
2,2'-bi-1,3-benzoxazol-5,5'-diamin
Phenol (di-)nitrieren, mit Oxalylchlorid kondensieren (DNPO-Synthese), (sanft) Reduzieren und erneut kondensieren.
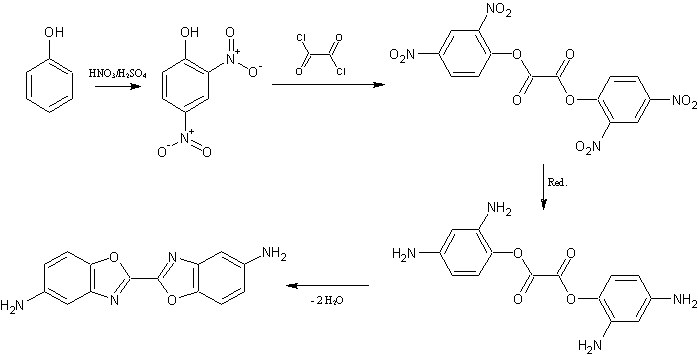
Die elegantere Route aus Chlorbenzol verläuft über eine Mononitrierung mit anschließender Reduktion, erneuter Nitrierung (oder wird NUR in 3-Stellung, ausgehend vom 4-Amino-Chlorbenzol nitriert?*) und Einführung einer Schutzgruppe (die im Sauren, Neutralen, hydrogenolytisch oder mit NaF angespalten wird. Falls eine säurestabile Schutzgruppe eingesetzt wird kann auch erst anschließend nitriert werden), Reduktion und Verkochung zum p-geschützten Diaminophenol. Kondensation mit Oxalylchlorid und PCl5 (+Protonenakzeptor) zum geschützten Benzoxazol. Letztlich Schutzgruppen abspalten. Dieser Weg ist zwar umständlich, aber lässt bei höheren Substitutionen eine Selektivität zu.
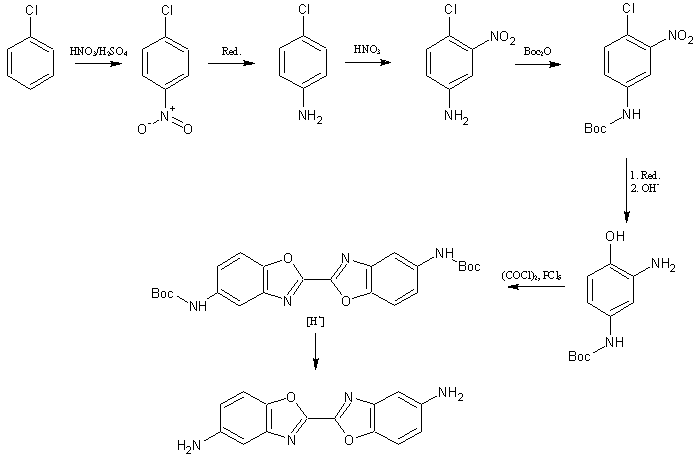
* Ich überlege mir aber nochmal nen schöneren Weg
Auch eine Möglichkeit wäre die Einführung einer Carbonyl-Schutzgruppe mit Carbonyldiimidazol (CDI):
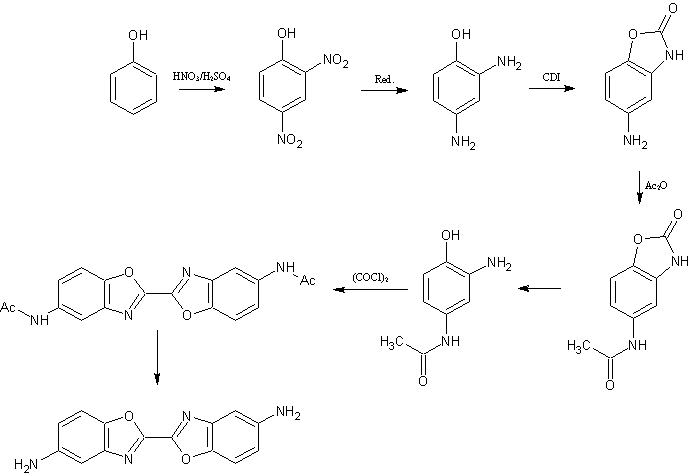
Die Aminogruppe in para-Stellung kann natürlich auch anders geschützt werden, die Schutzgruppe sollte sich nur anders abtrennen lassen als die Carbonylgruppe des Benzoxazolon.
Letzte Aufgabe von mir erstmal:
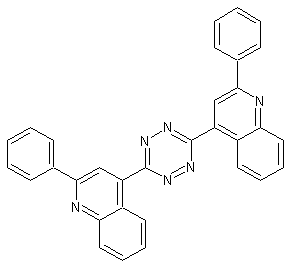
3,6-Bis-(2-phenylchinolin-4-yl)-1,2,4,5-Tetrazin. Alle Edukte sollen eine Molmasse unter 110 g/mol haben.
Phenol (di-)nitrieren, mit Oxalylchlorid kondensieren (DNPO-Synthese), (sanft) Reduzieren und erneut kondensieren.

Die elegantere Route aus Chlorbenzol verläuft über eine Mononitrierung mit anschließender Reduktion, erneuter Nitrierung (oder wird NUR in 3-Stellung, ausgehend vom 4-Amino-Chlorbenzol nitriert?*) und Einführung einer Schutzgruppe (die im Sauren, Neutralen, hydrogenolytisch oder mit NaF angespalten wird. Falls eine säurestabile Schutzgruppe eingesetzt wird kann auch erst anschließend nitriert werden), Reduktion und Verkochung zum p-geschützten Diaminophenol. Kondensation mit Oxalylchlorid und PCl5 (+Protonenakzeptor) zum geschützten Benzoxazol. Letztlich Schutzgruppen abspalten. Dieser Weg ist zwar umständlich, aber lässt bei höheren Substitutionen eine Selektivität zu.

* Ich überlege mir aber nochmal nen schöneren Weg
Auch eine Möglichkeit wäre die Einführung einer Carbonyl-Schutzgruppe mit Carbonyldiimidazol (CDI):

Die Aminogruppe in para-Stellung kann natürlich auch anders geschützt werden, die Schutzgruppe sollte sich nur anders abtrennen lassen als die Carbonylgruppe des Benzoxazolon.
Letzte Aufgabe von mir erstmal:
3,6-Bis-(2-phenylchinolin-4-yl)-1,2,4,5-Tetrazin. Alle Edukte sollen eine Molmasse unter 110 g/mol haben.

I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
3,6-Bis-(2-phenylchinolin-4-yl)-1,2,4,5-tetrazin
Anilin 1, Benzaldehyd 2 und Brenztraubensäure 3 werden unter Refluxieren zum Cinchophen 4 umgesetzt und mit KSCN in der Hitze zum Nitril 5 überführt. Nach Umsetzung mit wasserfreiem Hydrazin und Oxidation mit Wasserstoffperoxid entsteht über 6 das gesuchte Tetrazin 7.
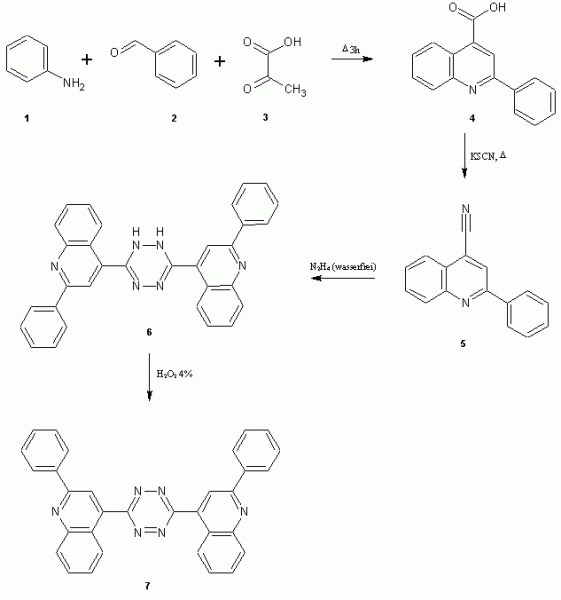
Weitaus interessanter wäre die Verwendung von Pyridin-2-carbaldehyd 8, da das entstehende Tetrazin 9 pro Molekül dann zwei Bipyridin-Einheiten haben würde und interessante Komplexe bildet. Um dem Ganzen noch die Krone aufzusetzen könnte man auch Terpyridin-4-carbonsäure 10 einsetzen, jedoch liegt der Hauptaugenmerk dann eher auf den komplexbildenden Eigenschaften des Bis(terpy)-tetrazins 11.
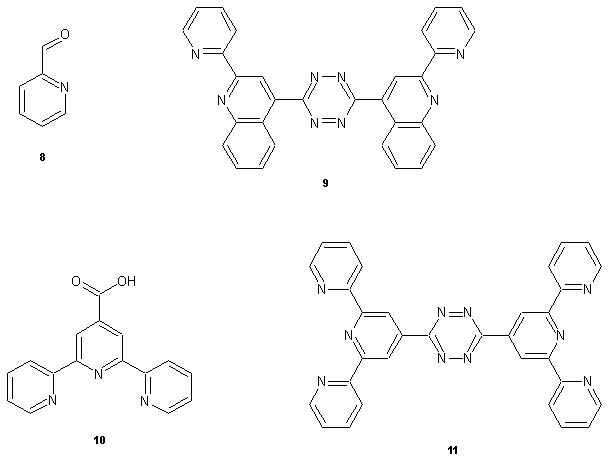
Anilin 1, Benzaldehyd 2 und Brenztraubensäure 3 werden unter Refluxieren zum Cinchophen 4 umgesetzt und mit KSCN in der Hitze zum Nitril 5 überführt. Nach Umsetzung mit wasserfreiem Hydrazin und Oxidation mit Wasserstoffperoxid entsteht über 6 das gesuchte Tetrazin 7.

Weitaus interessanter wäre die Verwendung von Pyridin-2-carbaldehyd 8, da das entstehende Tetrazin 9 pro Molekül dann zwei Bipyridin-Einheiten haben würde und interessante Komplexe bildet. Um dem Ganzen noch die Krone aufzusetzen könnte man auch Terpyridin-4-carbonsäure 10 einsetzen, jedoch liegt der Hauptaugenmerk dann eher auf den komplexbildenden Eigenschaften des Bis(terpy)-tetrazins 11.

I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
-
Bariumchlorid
- Illumina-Mitglied
- Beiträge: 1570
- Registriert: Samstag 6. Juni 2009, 21:37
Zur Lett's findeste viel/nicht viel in der Literatur, vorallem mit KSCN. (Alternativ könnte man auch über das Säureamid und POCl3 zum Nitril kommen. >>Überlesen.)
So... weiter gehts:
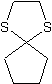
aus Adipinsäure (Damit endlich mal wer anders darf )
)
So... weiter gehts:
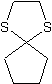
aus Adipinsäure (Damit endlich mal wer anders darf
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
-
Bariumchlorid
- Illumina-Mitglied
- Beiträge: 1570
- Registriert: Samstag 6. Juni 2009, 21:37
Hmm. Ich hab nur zwei Sachen bzgl. des Bleisalzes gefunden. Aber eine allzu milde Geschichte scheint mir das sowieso nicht zu sein.
Vorschlag hierfür :
Vielleicht anfangs etwas harsch, aber Adipinsäure mit Bariumcarbonat zum Cyclopentanon umsetzen, welches dann mit 1,2-Ethanthiol und Bortrifluorid zum entsprechenden Vollacetal umgesetzt wird.
Vorschlag hierfür :
Vielleicht anfangs etwas harsch, aber Adipinsäure mit Bariumcarbonat zum Cyclopentanon umsetzen, welches dann mit 1,2-Ethanthiol und Bortrifluorid zum entsprechenden Vollacetal umgesetzt wird.
Ist richtig,... Finde die Letts aber eigentlich nur mit KSCN beschrieben (kenne aber auch die Pb(SCN)2-Geschichte irgendwoher) und sie ist nicht gerade das mildeste, allerdings sollte das Cinchophen nicht sooo empfindlich sein... und wenn doch dann eben über das Amid...
Und die Lösung ist natürlich richtig
Endlich mal wer anderes dran^^
Und die Lösung ist natürlich richtig
Endlich mal wer anderes dran^^
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
Um mal wieder die grauen Zellen zu beanspruchen hier mal wieder was neues:
ausgehend von 4-Nitrotoluen
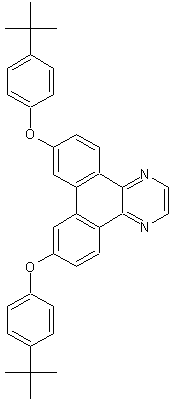
UPDATE: Hier ein Tipp: 4-tBu-Phenol sei als Edukt gegeben und es werden größere Mengen KCN benötigt (zumindest bei der von mit angedachten Route).
UPDATE 2: Es sind grundsätzlich unterschiedliche Wege möglich, wobei an einige Stellen die Reihenfolge (für die beste Ausbeute) einfach empirisch ermittelt werden müsste. Aber es gibt 2 Synthesestufen die mit einer anderen Reagenz in einer Stufe abgehakt werden können (extrem schlechte Ausbeute, daher sollte man den Weg über 2 Stufen gehen).
ausgehend von 4-Nitrotoluen

UPDATE: Hier ein Tipp: 4-tBu-Phenol sei als Edukt gegeben und es werden größere Mengen KCN benötigt (zumindest bei der von mit angedachten Route).
UPDATE 2: Es sind grundsätzlich unterschiedliche Wege möglich, wobei an einige Stellen die Reihenfolge (für die beste Ausbeute) einfach empirisch ermittelt werden müsste. Aber es gibt 2 Synthesestufen die mit einer anderen Reagenz in einer Stufe abgehakt werden können (extrem schlechte Ausbeute, daher sollte man den Weg über 2 Stufen gehen).
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
Hier die Auflösung:
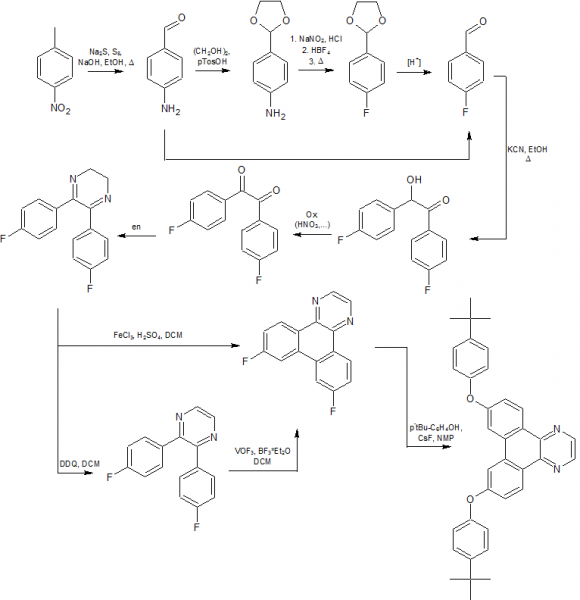
Dabei sind durchaus einige andere Möglichkeiten vorhanden. Ob das Aldehyd die Schiemann-Reaktion übersteht weiß ich nicht, ich denke aber es ist sinnvoller das Aldehyd zu schützen um eine Oxidation zu verhindern. Der Schritt der Cyclisierung mit FeCl3 empfiehlt sich nicht, da die Ausbeuten dabei typischerweise < 10% ist während sich bei der Verwendung von zwei Stufen das Produkt mit Ausbeuten von >50 % zu erwarten sind. Die Bildung der Diarylether könnte prinzipiell auch eher gemacht werden, aber ich denke dass sich so (gesamt betrachtet) besser Ausbeuten bei kurzen Reaktionszeiten erreichen lassen. Außerdem sind auch andere Bildungsmöglichkeiten der Ether vorhanden (Hartwig-Buchwald, Chan-Lam, Ullmann,... bei denen zuvor keine Schiemann Reaktion, sondern eine Sandmeyer-R. erfolgen würde)
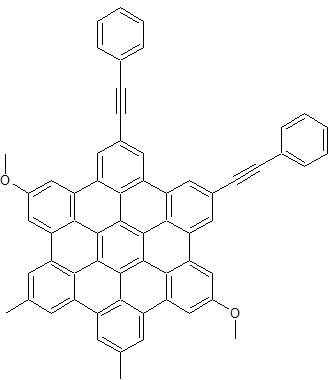
als Nächstes:
aus kommerziellen Produkten

Dabei sind durchaus einige andere Möglichkeiten vorhanden. Ob das Aldehyd die Schiemann-Reaktion übersteht weiß ich nicht, ich denke aber es ist sinnvoller das Aldehyd zu schützen um eine Oxidation zu verhindern. Der Schritt der Cyclisierung mit FeCl3 empfiehlt sich nicht, da die Ausbeuten dabei typischerweise < 10% ist während sich bei der Verwendung von zwei Stufen das Produkt mit Ausbeuten von >50 % zu erwarten sind. Die Bildung der Diarylether könnte prinzipiell auch eher gemacht werden, aber ich denke dass sich so (gesamt betrachtet) besser Ausbeuten bei kurzen Reaktionszeiten erreichen lassen. Außerdem sind auch andere Bildungsmöglichkeiten der Ether vorhanden (Hartwig-Buchwald, Chan-Lam, Ullmann,... bei denen zuvor keine Schiemann Reaktion, sondern eine Sandmeyer-R. erfolgen würde)
als Nächstes:
aus kommerziellen Produkten

I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]