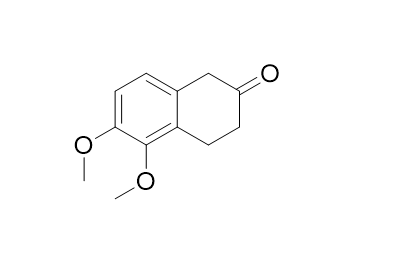
Ist das ein reines Gedankenspiel oder wozu wird das Molekül gebraucht bzw. welche besonderen Eigenschaften hat es?
Retrosynthese
Moderator: Moderatoren
Mir fällt gerade auf, dass mir das vorherige Molekül bekannt vorkam, zumindest so ähnlich. Wenn man 2-3 Reaktionsschritte wegnimmt, kommt ein gewisses anderes Molekül raus. Ich glaube, du weißt was ich meine. 
Ist das ein reines Gedankenspiel oder wozu wird das Molekül gebraucht bzw. welche besonderen Eigenschaften hat es?
Ist das ein reines Gedankenspiel oder wozu wird das Molekül gebraucht bzw. welche besonderen Eigenschaften hat es?
Hehe genau  Im Prinzip sollte es sogar daraus möglich sein. (Wer sich wundert: Mehr Infos dazu in den kommenden Wochen.)
Im Prinzip sollte es sogar daraus möglich sein. (Wer sich wundert: Mehr Infos dazu in den kommenden Wochen.)
Der Stoff selber hat keine wirklich Bewandtnis, verwendet man daran jedoch lange Seitenketten landet man bei Flüssigkristallen mit columnaren Mesophasen.
Falls du das neue Molekül meinst: nicht wirklich. Eben ein Substituiertes Hexa-peri-benzocoronen - die unterschiedlichen Substituenten sollten nur dabei helfen zu erkennen, wie man das Molekül aufbaut. Aber es fluoresziert mit Sicherheit schön xD
Der Stoff selber hat keine wirklich Bewandtnis, verwendet man daran jedoch lange Seitenketten landet man bei Flüssigkristallen mit columnaren Mesophasen.
Falls du das neue Molekül meinst: nicht wirklich. Eben ein Substituiertes Hexa-peri-benzocoronen - die unterschiedlichen Substituenten sollten nur dabei helfen zu erkennen, wie man das Molekül aufbaut. Aber es fluoresziert mit Sicherheit schön xD
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
- frankie
- Illum.-Ass.
- Beiträge: 1941
- Registriert: Dienstag 10. April 2007, 17:00
- Wohnort: Res Publica Austria
Ich versuchs einmal...
Vorstufen:
[1] Umsetzung von 4-methoxy-Benzylbromid mit KCN zum Nitril nach Kolbe liefert 4-methoxy-Benzylcyanid, welches in einer Grignard-Reaktion mit 4-methoxybenzylmagnesiumbromid zum Imin und nach Hydrolyse zum 1,3-bis(4-methoxyphenyl)-aceton reagiert.
[2] 4-methylbenzaldehyd wird in einer Benzoin-Kondensation (mit KCN in wässrig. EtOH, Reflux) zum entsprechenden Benzoin-Derivat umgesetzt, welches wiederum zum Diketon oxidiert wird.
[3] Noch eine Benoin-Kondensation ausgehend von 4-Fluorbenzaldehyd zum entsprechenden Benzoin-Derivat, welches zum Diketon oxidiert, dann mit Hydrazin zum Hydrazon umgesetzt und abschließend zum bis(4-fluorphenyl)ethin oxidiert wird.
Produktsynthese:
Klassisch, zuerst die Aldolreaktion von [1] mit [2] zum Cyclopentadienon-Derivat (Reflux, Dioxan), dann die Cycloaddition mit [3] zum subst. Hexaphenylbenzol und die Oxidation mit FeCl3 in Nitromethan. Abschließend Sonogashira-Hupplung (CuI, Pd-kat, THF) mit Phenylacetylen.
Vorstufen:
[1] Umsetzung von 4-methoxy-Benzylbromid mit KCN zum Nitril nach Kolbe liefert 4-methoxy-Benzylcyanid, welches in einer Grignard-Reaktion mit 4-methoxybenzylmagnesiumbromid zum Imin und nach Hydrolyse zum 1,3-bis(4-methoxyphenyl)-aceton reagiert.
[2] 4-methylbenzaldehyd wird in einer Benzoin-Kondensation (mit KCN in wässrig. EtOH, Reflux) zum entsprechenden Benzoin-Derivat umgesetzt, welches wiederum zum Diketon oxidiert wird.
[3] Noch eine Benoin-Kondensation ausgehend von 4-Fluorbenzaldehyd zum entsprechenden Benzoin-Derivat, welches zum Diketon oxidiert, dann mit Hydrazin zum Hydrazon umgesetzt und abschließend zum bis(4-fluorphenyl)ethin oxidiert wird.
Produktsynthese:
Klassisch, zuerst die Aldolreaktion von [1] mit [2] zum Cyclopentadienon-Derivat (Reflux, Dioxan), dann die Cycloaddition mit [3] zum subst. Hexaphenylbenzol und die Oxidation mit FeCl3 in Nitromethan. Abschließend Sonogashira-Hupplung (CuI, Pd-kat, THF) mit Phenylacetylen.
It is always better to have no ideas than false ones; to believe nothing, than to believe what is wrong.
(Thomas Jefferson)
(Thomas Jefferson)
Genau so 
Bei [1] meinst du natürlich 4-Methoxybenzylmagnesiumbromid. Es wären auch modifizierte Perkin-Rx möglich, gibt ein paar spezielle, die überwiegend zum entsprechenden Diarylaceton gehen, weshalb ich auch die gleichen Substituenten gewählt habe, und die Methoxyphenylessigsäure Recht günstig ist. Aber 'ne Sonogashira über Fluor?
Bei [1] meinst du natürlich 4-Methoxybenzylmagnesiumbromid. Es wären auch modifizierte Perkin-Rx möglich, gibt ein paar spezielle, die überwiegend zum entsprechenden Diarylaceton gehen, weshalb ich auch die gleichen Substituenten gewählt habe, und die Methoxyphenylessigsäure Recht günstig ist. Aber 'ne Sonogashira über Fluor?
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
- frankie
- Illum.-Ass.
- Beiträge: 1941
- Registriert: Dienstag 10. April 2007, 17:00
- Wohnort: Res Publica Austria
Wo  Ja, das Fluor ist vielleicht nicht die beste Wahl, da hast du Recht. Aus irgendeinem Grund empfand ich es als passend. Iod oder Brom wären besser geeignet...
Ja, das Fluor ist vielleicht nicht die beste Wahl, da hast du Recht. Aus irgendeinem Grund empfand ich es als passend. Iod oder Brom wären besser geeignet...
Jetzt bin ich dran. Bitte aus nicht-zyklischen Standardchemikalien.
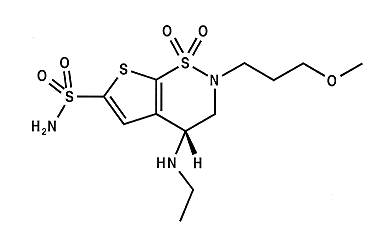
Jetzt bin ich dran. Bitte aus nicht-zyklischen Standardchemikalien.

It is always better to have no ideas than false ones; to believe nothing, than to believe what is wrong.
(Thomas Jefferson)
(Thomas Jefferson)
Werd mich ma ranmachen wenn ich aus Italien zurück bin... Falls es bis dahin noch nicht gelöst ist... Aber man erkennt im Inneren schon ein symmetrisches Thiophen  ich war wenigstens so nett und hab alle Doppelbindungen so gedreht dass es leichter wird ^^
ich war wenigstens so nett und hab alle Doppelbindungen so gedreht dass es leichter wird ^^
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
Ich hätte gerne nen Tipp für den Anfang, und zwar bereitet mir der Aufbau des Thiophenringes Schwierigkeiten... Die Cyclisierung zu dem Sechsring wird dann über ne Halogenacetylgruppe am Thiophen gemacht, wobei das Sulfonamid vorher bereits da sein muss, anschließend noch reduziert, (ggf das Ethylamin reduktiv vom Keton aus gleich mitmachen), die Methoxyalkoxygruppe würde ich als Halogenid kaufen, sollte ja drinne sein. Also mein Problem ist das 3-Acetylthiophen, vermutlich geht man über das 2,5-Dichlor-3-acetylthiophen und setzt zu irgendwelchen Thioethern um die anschließend freigesetzte und zu den Sulfonamiden oxidiert werden, aber irgendwie wäre mit etwas mit Chlorsulfosäure lieber, was einfaches halt  Also gibts nen Tipp?
Also gibts nen Tipp?
EDIT: hab man im Kleemann-Engel gespickt... ist schon alles ein wenig komplexer, aber ich erkenne einige meiner Ideen wieder, dennoch müsste man sich noch die jeweiligen Thiophen-derivate machen, die teilweise auch schon ein paar Stufen mehr erfodern
EDIT: hab man im Kleemann-Engel gespickt... ist schon alles ein wenig komplexer, aber ich erkenne einige meiner Ideen wieder, dennoch müsste man sich noch die jeweiligen Thiophen-derivate machen, die teilweise auch schon ein paar Stufen mehr erfodern
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
Da der Thread wieder in der Versenkung verschwunden ist hier mal eine neue Aufgabe:
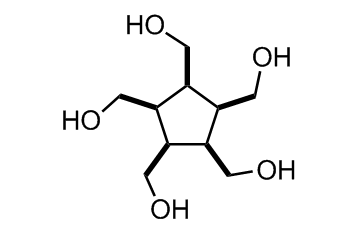
Wie immer aus kommerziellen Edukten. Das ganze ist ziemlich tricky und 1,2,3,4,5-Pentamethylenecyclopentan ist mangels "Stereokontrolle" nicht das gesuchte Zwischenprodukt!

Wie immer aus kommerziellen Edukten. Das ganze ist ziemlich tricky und 1,2,3,4,5-Pentamethylenecyclopentan ist mangels "Stereokontrolle" nicht das gesuchte Zwischenprodukt!
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
@virgil: Die Antwort war natürlich richtig. Ziel des Threads ist es aber, ohne das direkte googeln entsprechender Synthesen Ideen und Herleitungen für ein Produkt zu entwickeln, daher habe ich das oben mal editiert. 
Hier gleich mal der erste Tipp:
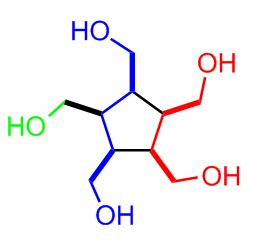
Die Farben repräsentieren die zusammenhängen C-Ketten der Ausgangsstufen. Da das ganze ziemlich tricky ist gibts natürlich auch mehr mehr Tipps, sofern nötig. Aber die Synthese ist ein recht schönes Beispiel an dem man sieht, dass Edukte und Produkt teilweise überhaupt nicht danach aussehen als würden sie zusammengehören.
Hier gleich mal der erste Tipp:

Die Farben repräsentieren die zusammenhängen C-Ketten der Ausgangsstufen. Da das ganze ziemlich tricky ist gibts natürlich auch mehr mehr Tipps, sofern nötig. Aber die Synthese ist ein recht schönes Beispiel an dem man sieht, dass Edukte und Produkt teilweise überhaupt nicht danach aussehen als würden sie zusammengehören.
I❤OC
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
There is no sadder sight in the world than to see a beautiful theory killed by a brutal fact. [T. Huxley]
The pursuit of knowledge is hopeless and eternal. Hooray! [Prof. H. J. Farnsworth]
Trust the rhythm and the rhyme of your own heartbeat. [C. Douglas]
- eule
- Illumina-Mitglied
- Beiträge: 822
- Registriert: Mittwoch 8. Januar 2014, 00:37
- Wohnort: europa
- Kontaktdaten:
tja, nach deinem Tip geht mir Diels-Alder nicht mehr aus dem Kopf, vllt. ist das auch völliger blödsinn, aber 3-Methylen-1,4-pentadien als Dien, Butindiol als Dienophil, in Ggw. von AlCl3 und späterer Hydrolyse für die OH-Gruppen,..., obwohl, das gibt doch einen 6-ring...
also eher ein 2,3-Pentadien, dazu formaldehyd?,... hmm, klingt auch irgendwie "murksig",...
ok, vergesst das einfach bye.
ok, google statt nachdenken brachte dann dieses:https://www.researchgate.net/publicatio ... clopentane
also eher ein 2,3-Pentadien, dazu formaldehyd?,... hmm, klingt auch irgendwie "murksig",...
ok, vergesst das einfach bye.
ok, google statt nachdenken brachte dann dieses:https://www.researchgate.net/publicatio ... clopentane
Unendliche Vielfalt in unendlicher Kombination.
Agressiv und feindselig, boshaft, manipulierend und hinterhältig, hämisch, überkritisch, herrschsüchtig und sinnlos brutal, das sind die Primärtugenden, die zusammengenommen Menschen vor allen anderen Spezies auszeichnen.
Agressiv und feindselig, boshaft, manipulierend und hinterhältig, hämisch, überkritisch, herrschsüchtig und sinnlos brutal, das sind die Primärtugenden, die zusammengenommen Menschen vor allen anderen Spezies auszeichnen.
-
Calciumcitrat
- Illumina-Mitglied
- Beiträge: 170
- Registriert: Montag 11. April 2011, 16:57
Literaturbekannt aus: http://www.rug.nl/research/portal/files ... thesis.pdf
2-Napthol mit Brom in Essigsäue bromieren (zum 1,6-Dibrom-2-hydroxynapthalen), dann mit Dimethylsulfat die Hydroxygruppe methylieren.
Anschließend die beiden Bromsubstituenten mit NaOMe unter Kupfer(I)-iodid Katalyse in 2,4,6-Trimethylpyridin durch Methoxygruppen substituieren (Arom. nukleoph. Subst.). Final mit Natrium in Ethanol und saurer Aufarbeitung via Birch reduzieren. Hat aber in den letzten beiden Schritten nur mittelmäßige Ausbeuten und benötigt säulenchromatographische Aufreinigung.
Besser funktioniert es ausgehend von 2-Hydroxy-3-methoxybenzaldehyd:
Mit Dimethylsulfat die Hydroxygruppe methylieren, dann Knoevenagel mit Malonsäure zur DImethoxyzimtsäure. Diese muss dann aber mit Pd/C und Wasserstoff hydriert werden, bevor die Carbonsäure mit Thionylchlorid zum Chlorid umgewandelt wird. Mit Diazomethan wird das α-Diazoketon hergestellt, welches dann Rhodiumkatalysiert durch eine Cycloaddition zum Zielprodukt umgesetzt wird. (Intramolekulare Buchner gefolgt von Trifluoressigsäurekatalysierter Umlagerung.)
Dies ist im Hobbylabor wohl eher nicht durchführbar. Die erste scheint aber, wenn man mit den notwendigen Aufreinigungsschritten vertraut ist, durchführbar.
2-Napthol mit Brom in Essigsäue bromieren (zum 1,6-Dibrom-2-hydroxynapthalen), dann mit Dimethylsulfat die Hydroxygruppe methylieren.
Anschließend die beiden Bromsubstituenten mit NaOMe unter Kupfer(I)-iodid Katalyse in 2,4,6-Trimethylpyridin durch Methoxygruppen substituieren (Arom. nukleoph. Subst.). Final mit Natrium in Ethanol und saurer Aufarbeitung via Birch reduzieren. Hat aber in den letzten beiden Schritten nur mittelmäßige Ausbeuten und benötigt säulenchromatographische Aufreinigung.
Besser funktioniert es ausgehend von 2-Hydroxy-3-methoxybenzaldehyd:
Mit Dimethylsulfat die Hydroxygruppe methylieren, dann Knoevenagel mit Malonsäure zur DImethoxyzimtsäure. Diese muss dann aber mit Pd/C und Wasserstoff hydriert werden, bevor die Carbonsäure mit Thionylchlorid zum Chlorid umgewandelt wird. Mit Diazomethan wird das α-Diazoketon hergestellt, welches dann Rhodiumkatalysiert durch eine Cycloaddition zum Zielprodukt umgesetzt wird. (Intramolekulare Buchner gefolgt von Trifluoressigsäurekatalysierter Umlagerung.)
Dies ist im Hobbylabor wohl eher nicht durchführbar. Die erste scheint aber, wenn man mit den notwendigen Aufreinigungsschritten vertraut ist, durchführbar.
Danke dir! Ich habe 10g 3-(2,3-Dimethoxyphenyl)propionsäure rumliegen (in der Uni). Habe nur noch nie mit Diazomethan gearbeitet, das ist das einzige was mich ein wenig abschreckt. Der Weg vom Naphthol aus hört sich nach einer billigen Alternative an, denn es kommen ja eigentlich nur sehr günstige Chemikalien in der Synthesesequenz zum Einsatz. Säulenchromatographie etc. ist mir selbstverständlich vertraut! 
-
Calciumcitrat
- Illumina-Mitglied
- Beiträge: 170
- Registriert: Montag 11. April 2011, 16:57
Dann wäre es für dich ja nur noch ein Dreistufer... Das Diazomethan ließe sich evtl durch Trimethylsilyldiazomethan ersetzen. Dieses ist etwas gutmütiger und kein Gas. Hier müsste man dann nicht über das Säurechlorid, sondern über ein gemischtes Anhydrid, gewonnen aus der Säure und Chloressigsäureethylester, gehen. (http://www.sciencedirect.com/science/ar ... 3901014587)
Es gibt noch einige andere Methoden zur Synthese von α-Diazoketonen ausgehend von Carbonsäuren, die aber in ihrer Range an tolerierten funkt. Gruppen eingeschränkt sind, da müsste man herumexperimentieren.
Die Rhodiumkatalyse ist kein Problem? (Schutzgas, etc.)
Es gibt noch einige andere Methoden zur Synthese von α-Diazoketonen ausgehend von Carbonsäuren, die aber in ihrer Range an tolerierten funkt. Gruppen eingeschränkt sind, da müsste man herumexperimentieren.
Die Rhodiumkatalyse ist kein Problem? (Schutzgas, etc.)