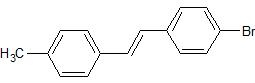
Na Aldehyd und Wittig ist ja schon mal gut.... Aber du meintest, dass du das Toluol para-Bromieren und zum Aldehyd oxidieren willst.... Jetzt liegt es auf der Hand, dass du bei dem anderen Toluol noch ein para-C-Atom einfügen musst. Mit welchen Reaktionen kann man denn C-Atome an einen Aromaten bekommen?
EDIT: Vielleicht hilft das: Hier ist vereinfacht dargestellt das Kohlenstoffgerüst deines Targets. Wir wissen wo die Wittig trennt und bekommen jetzt ein C
7 und ein C
8-Synthon. Die Frage ist an welches der beiden wir das zusätzliche C-Atom anbringen. Entweder muss es eine Methylgruppe werden oder eine Gruppe, die am Ende die Reaktion zur Wittig erlaubt. Der Weg dahin ist vielfältig, aber man sollte hier durchaus ein optimiertes Arbeiten anstreben, aber es gäbe auch längere Varianten. Es könnte hilfreich sein, wenn du uns ein paar Schlagwörter nennst von dem was du erkennt, dann sehen wir ob du auf dem richtigen Weg bist oder eher noch nicht - wobei jetzt nicht mehr allzuviel übrig bleibt.