wie einige vllt mitbekommen haben bin ich zurzeit auf einen ziemlichen (Azo)-farbstofftrip. Im März kommenden Jahres absolviere ich u.A. für mein MSA (Mittleren Schulabschluss) eine Präsentation in Chemie über das Thema: Vom Erdöl zum (Azo)-farbstoff. Immo bin ich dabei mir die benötigten Chems zu besorgen. Ich habe vor 4-Aminophenol zu diazotieren und dies anschließend mit Hydrochinon zu koppeln. Das Problem dabei ist nur, wie der Titel bereits sagt, das ich nicht mit der Nomenklatur dessen klarkomme. Ich möchte nicht den IUPAC Namen wissen sondern nur so eine Art Trivialnamen. Hat jemand eine Ahnung wie dieser Farbstoff heißen könnte? *Zu Felix, Sascha, Cyan, frankie und Ammo und den anderen guck*
Nomenklatur bzgl. Azofarbstoffe
Moderator: Moderatoren
-
t0bychemie
- Illum.-Ass.
- Beiträge: 1056
- Registriert: Freitag 4. Januar 2008, 11:23
- Kontaktdaten:
Nomenklatur bzgl. Azofarbstoffe
Ahoi  ,
,
wie einige vllt mitbekommen haben bin ich zurzeit auf einen ziemlichen (Azo)-farbstofftrip. Im März kommenden Jahres absolviere ich u.A. für mein MSA (Mittleren Schulabschluss) eine Präsentation in Chemie über das Thema: Vom Erdöl zum (Azo)-farbstoff. Immo bin ich dabei mir die benötigten Chems zu besorgen. Ich habe vor 4-Aminophenol zu diazotieren und dies anschließend mit Hydrochinon zu koppeln. Das Problem dabei ist nur, wie der Titel bereits sagt, das ich nicht mit der Nomenklatur dessen klarkomme. Ich möchte nicht den IUPAC Namen wissen sondern nur so eine Art Trivialnamen. Hat jemand eine Ahnung wie dieser Farbstoff heißen könnte? *Zu Felix, Sascha, Cyan, frankie und Ammo und den anderen guck*
wie einige vllt mitbekommen haben bin ich zurzeit auf einen ziemlichen (Azo)-farbstofftrip. Im März kommenden Jahres absolviere ich u.A. für mein MSA (Mittleren Schulabschluss) eine Präsentation in Chemie über das Thema: Vom Erdöl zum (Azo)-farbstoff. Immo bin ich dabei mir die benötigten Chems zu besorgen. Ich habe vor 4-Aminophenol zu diazotieren und dies anschließend mit Hydrochinon zu koppeln. Das Problem dabei ist nur, wie der Titel bereits sagt, das ich nicht mit der Nomenklatur dessen klarkomme. Ich möchte nicht den IUPAC Namen wissen sondern nur so eine Art Trivialnamen. Hat jemand eine Ahnung wie dieser Farbstoff heißen könnte? *Zu Felix, Sascha, Cyan, frankie und Ammo und den anderen guck*
Interessenvereinigung Naturwissenschaft und Technik IVNT e.V.
Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
-
t0bychemie
- Illum.-Ass.
- Beiträge: 1056
- Registriert: Freitag 4. Januar 2008, 11:23
- Kontaktdaten:
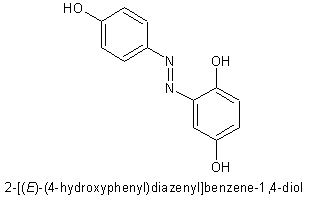
Genau das mein ich  Ich dachte aber eigentlich das die Azogruppe sich an der Hydroxylgruppe vom Hydrochinon anlagerst und nicht an der Stelle wo es bei deinem Bild ist
Ich dachte aber eigentlich das die Azogruppe sich an der Hydroxylgruppe vom Hydrochinon anlagerst und nicht an der Stelle wo es bei deinem Bild ist 
Interessenvereinigung Naturwissenschaft und Technik IVNT e.V.
Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Was soll das denn dann ergeben?  Das könnte höchstens zu ner Veretherung o.ä. führen, wobei du das Diazonium aber als Abgangsgruppe nehmen würdest und wo du einen Kupferkatalysator bräuchtest, falls es überhaupt geht (bei größerem Rest am Diazonium unwahrscheinlich, bei Diazomethan z.B. aber üblich). Irgendsoeine "Azooxy"-Verbindung wäre wohl nicht sonderlich stabil (drei derart elektronegative Atome? Das käme einem etwas verschärften Azid gleich!). Ne, Diazoniumsalze sind Elektrophile, die den Benzolring angreifen.
Das könnte höchstens zu ner Veretherung o.ä. führen, wobei du das Diazonium aber als Abgangsgruppe nehmen würdest und wo du einen Kupferkatalysator bräuchtest, falls es überhaupt geht (bei größerem Rest am Diazonium unwahrscheinlich, bei Diazomethan z.B. aber üblich). Irgendsoeine "Azooxy"-Verbindung wäre wohl nicht sonderlich stabil (drei derart elektronegative Atome? Das käme einem etwas verschärften Azid gleich!). Ne, Diazoniumsalze sind Elektrophile, die den Benzolring angreifen.
"It is arguably true that the tetrapyrrole system is Nature's most remarkable creation."
- Claude Rimington
- Claude Rimington
-
t0bychemie
- Illum.-Ass.
- Beiträge: 1056
- Registriert: Freitag 4. Januar 2008, 11:23
- Kontaktdaten:
Okay  Danke, das hat mich schon mal weiter gebracht.
Danke, das hat mich schon mal weiter gebracht. 
Interessenvereinigung Naturwissenschaft und Technik IVNT e.V.
Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

- frankie
- Illum.-Ass.
- Beiträge: 1941
- Registriert: Dienstag 10. April 2007, 17:00
- Wohnort: Res Publica Austria
hätte zu dem thema noch die frage, ob folgendes möglich wär:
Dreifache Sulfonierenung/ Nitrierenung von Phenol --> 2,4,6 Trinitrophenol. Reduktion der Nitrogruppen zum Amin (wie? - bechamp reduktion geht nicht), diazotierung mit salpetriger Säure und Kupplung an Aromaten. Das ist nur ein Gedanke, der hoffentlich nicht gleich wieder niedergemacht wird ;-)
mfg
Dreifache Sulfonierenung/ Nitrierenung von Phenol --> 2,4,6 Trinitrophenol. Reduktion der Nitrogruppen zum Amin (wie? - bechamp reduktion geht nicht), diazotierung mit salpetriger Säure und Kupplung an Aromaten. Das ist nur ein Gedanke, der hoffentlich nicht gleich wieder niedergemacht wird ;-)
mfg
It is always better to have no ideas than false ones; to believe nothing, than to believe what is wrong.
(Thomas Jefferson)
(Thomas Jefferson)
- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
Zur Entsorgung von Pikrinsäure wird mit Dithionitlösung aufgekocht, wobei das Triamin entsteht. Das sollte auch quantitativ durchführbar sein. Inwieweit dann eine Tri-Azotierung und Kupplung möglich ist weiß ich nicht.
"It is arguably true that the tetrapyrrole system is Nature's most remarkable creation."
- Claude Rimington
- Claude Rimington
-
t0bychemie
- Illum.-Ass.
- Beiträge: 1056
- Registriert: Freitag 4. Januar 2008, 11:23
- Kontaktdaten:
Ich hab nochmal eine Frage: Du sagtest ja das die Azogruppe am Ring andockt, da dieser ja elektronenreicher ist. Jedoch ist die Azogruppe z.B. beim 2-Naphtholorange auch an der Hydroxylgruppe und nicht am Ring. Wie kann ich das jetzt verstehen? 
Interessenvereinigung Naturwissenschaft und Technik IVNT e.V.
Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
-
t0bychemie
- Illum.-Ass.
- Beiträge: 1056
- Registriert: Freitag 4. Januar 2008, 11:23
- Kontaktdaten:
Komisch wie ich darauf gekommen bin. Für mich war das kla das die Azogruppe sich immer an der Hydroxylgruppe anlagert. Naja egal. Btw wie sinnvoll ist es mit Sulfamidsäure die freie salpetrige Säure zu zerstören speziell bei meinem Versuch. Oder anders gefragt wann ist es sinnvoll? Den Ring könnte das NO2- ja nicht angreifen.
Mfg
Mfg
Interessenvereinigung Naturwissenschaft und Technik IVNT e.V.
Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

- Cyanwasserstoff
- Illumina-Admin
- Beiträge: 6303
- Registriert: Sonntag 7. Mai 2006, 20:41
- Kontaktdaten:
-
t0bychemie
- Illum.-Ass.
- Beiträge: 1056
- Registriert: Freitag 4. Januar 2008, 11:23
- Kontaktdaten:
Um keinen neuen Thread aufzumachen benutze ich den mal..
Hat jemand von euch Azobenzol schonmal hergestellt oder es sogar noch da und könnte mir davon mal ein Photo knipsen? Ich würde gern die Wellenlängenverschiebung von der Aminogruppe in einer Präsentation zeigen aber Google gibt kein Bild her.. Kann auch nur eine Lösung von dem Azobenzol sein, danke
Hat jemand von euch Azobenzol schonmal hergestellt oder es sogar noch da und könnte mir davon mal ein Photo knipsen? Ich würde gern die Wellenlängenverschiebung von der Aminogruppe in einer Präsentation zeigen aber Google gibt kein Bild her.. Kann auch nur eine Lösung von dem Azobenzol sein, danke
Interessenvereinigung Naturwissenschaft und Technik IVNT e.V.
Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

- frankie
- Illum.-Ass.
- Beiträge: 1941
- Registriert: Dienstag 10. April 2007, 17:00
- Wohnort: Res Publica Austria
Du bist einfach nur faul, gel  Frag doch den guten Christian von VC, er hat immerhin eine Synthesevorschrift hierzu gepostet ... ich denke nicht, dass er etwas dagegen hätte...
Frag doch den guten Christian von VC, er hat immerhin eine Synthesevorschrift hierzu gepostet ... ich denke nicht, dass er etwas dagegen hätte...
mfg
mfg
It is always better to have no ideas than false ones; to believe nothing, than to believe what is wrong.
(Thomas Jefferson)
(Thomas Jefferson)
-
t0bychemie
- Illum.-Ass.
- Beiträge: 1056
- Registriert: Freitag 4. Januar 2008, 11:23
- Kontaktdaten:
Da hab ich mich wohl im Namen geirrt, ich meinte natürlich Aminoazobenzol.. btw es hat sich glücklicherweise ein Aminoazobenzol Besitzer gefunden  danke trotzdem, Jan
danke trotzdem, Jan 
Interessenvereinigung Naturwissenschaft und Technik IVNT e.V.
Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

Der Verein für alle, die gerne selbst forschen und experimentieren.
Homepage: www.ivnt.de

-
Tempomat300
- Illumina-Mitglied
- Beiträge: 15
- Registriert: Donnerstag 21. Oktober 2010, 12:03