Dieser Artikel ist eine Gemeinschaftsarbeit von lemmi und mgritsch. Die Idee zur Analysenmethode stammt von mgritsch, sie wurde dann in gemeinsam durchgeführten Experimenten erprobt. Die hier wiedergegebenen Versuche wurden von lemmi dokumentiert. Die Autoren haben die Rohdaten unabhängig voneinander ausgewertet. Die graphische Auswertung stammt von lemmi, während mgritsch die mathematische Auswertung vorgenommen hat.
Diclofenac ist ein Medikament aus der Gruppe der sogenannten nichtsteroidalen Antiphlogistika (oder Antirheumatika), abgekürzt NSAR, das seit 1974 therapeutisch angewendet wird und unter dem Markennamen VoltarenR bekannt ist. Diclofenac ist eine Carbonsäure, wird aber als Natrium- (seltener auch als Kalium-) Salz angewendet. Zur quantitativen Bestimmung wird im aktuellen europäischen Arzneibuch eine potentiometrische Titration in wasserfreier Essigsäure angegeben[1]. Ziel der vorliegenden Arbeit war es, eine einfachere Bestimmungsmethode in wässrigem Medium zu entwickeln.
Grundprinzip des Verfahrens:
Um den Gehalt an Na-Salz einer schwachen Säure zu bestimmen, wird ein molarer Überschuss einer starken Säure wie HCl zugesetzt. Danach liegt im Prinzip alles Na als in einer Titration nicht störendes NaCl vor, die schwache Säure als freie Säure und daneben gibt es noch einen Rest-Überschuss an HCl. Bei der Titration dieser Mischung wird man also zwei Sprünge finden - einmal nachdem aller Rest-Überschuss an HCl verbraucht ist und der pH nur noch von der schwachen Säure bestimmt wird; den zweiten Sprung dann wenn auch die schwache Säure neutralisiert ist. Der Gehalt ergibt sich somit aus der Differenz des Verbrauchs an Maßlösung zwischen diesen beiden Äquivalenzpunkten. Damit der erste Sprung noch erkennbar ist, muss die schwache Säure z.B bei Arbeit mit einer 0,1-M Maßlösung rein praktisch einen pKs >3 haben; damit der zweite Äquivalenzpunkt erkennbar bleibt muss der pKs < 9 sein, in diesem Bereich funktioniert das Verfahren.
Da Diclofenac als freie Säure schlecht wasserlöslich ist (lt. Wikipedia nur 2,37 mg/l) muss in einem methanolisch-wässrigen Medium gearbeitet werden, sonst würde die Säure sofort ausfallen und keine vernünftige Aufnahme einer pH-Kurve möglich sein. Der Zusatz von Methanol verschiebt zwar Dissoziationsgleichgewichte und somit auch den pH-Wert von Äquivalenzpunkten, bei Aufnahme einer Kurve stört das aber nicht weiter - man ist nicht davon abhängig wo genau ein Indikator umschlägt. Daher (und aus anderen, weiter unten erläuterten Gründen) ist grundsätzlich eine potentiometrische Arbeitsweise mittels pH-Elektrode erforderlich.
Material/Geräte:
Analysenwaage, Messkolben 100 ml, Messpipetten 10 ml, Messzylinder 50 ml, Bechergläser 100 ml, Magnetrührer, ph-Meter mit Anzeige auf 0,01 pH, Feinbürette 10 ml (Unterteilung in 0,02 ml); 30 ml-Soxhlet-Extraktionsapparatur, Wasserbad, Reibschale
Chemikalien:
Methanol p.a.


Salzsäure 1 N


Natronlauge 1 N

Analysensubstanzen:
Natriumacetat Trihydrat p.a.
Diclofenac-Natrium

bzw. Diclofenac-Natrium-haltiges Arzneimittel
Versuchsdurchführung:
Vorbereitung der Titerlösungen:
Benötigt werden 0,1 N Natronlauge und 0,1 N Salzsäure. Man stellt zunächst 1 N Natronlauge bzw Salzsäure her (Anleitung) - die Natronlauge muss carbonatfrei sein ! – und bestimmt deren Titer möglichst exakt, vor allem den der Salzsäure, die später als Vergleichslösung dient. Dann werden durch Verdünnen mit kohlendioxidfreiem, d.h. frisch abgekochtem, Wasser die entsprechenden 0,1 N Lösungen hergestellt. Die Verdünnung der Salzsäure muss unter Berücksichtigung des Titers besonders sorgfältig geschehen. Die fertigen Maßlösungen werden luftdicht verschlossen aufbewahrt und am besten unverzüglich eingestellt und verwendet.
Das pH-Meter wird direkt vor der Versuchsdurchführung mit Hilfe von Standardpufferlösungen neu kalibriert. Das verwendet Methanol muss analysenrein und vor allem säurefrei sein.
Allgemeines Vorgehen bei der Durchführung der potentiometrischen Titration:
In einem 100 ml-Becherglas löst man eine genau gewogene Menge der zu titrierenden Substanz, die ungefähr 0,5 mmol (ca. 160 mg) Diclofenac-Natrium entsprechen soll, in 40 ml Methanol und setzt mit einer Messpipette 10,0 ml 0,1 N Salzsäure zu. Das Becherglas wird auf einem Magnetrührer platziert und die pH-Elektrode eingetaucht. Dann wird aus einer Feinbürette 0,1 N Natronlauge in kleinen Volumenanteilen zugesetzt und jedes Mal gewartet, bis sich die Anzeige des pH-Meters stabilisiert hat, was anfangs rasch geht (wenige Sekunden), in der Nähe des Äquivalenzpunktes aber bis zu 3-4 Minuten dauern kann! Der pH-Wert wird für jeden Titrierschritt in einer Tabelle notiert. Man geht so vor, dass man anfangs in Schritten von 1 oder 0,5 ml titriert und die Titrierschritte auf 0,25 bis 0,2 ml verkleinert, wenn sich abzeichnet, dass der Anstieg des pH-Wertes steiler zu werden beginnt. Bei der Titerstellung der Natronlauge sind, wegen des sehr steilen pH-Anstiegs am Äquivalenzpunkt, Schritte von 0,1 ml empfehlenswert. Nach Überschreiten des Äquivalenzpunktes wird in langsam zunehmend größeren Schritten weiter titriert, bis die pH-Sprünge wieder so klein werden, wie zu Beginn der Messungen, also die Titrationskurve wieder sehr flach verläuft. In der Regel müssen dazu 15-16 ml NaOH aufgewendet werden. Der Zeitaufwand beträgt pro Titration ca. 1 Stunde! (Die Titerstellung der Natronlauge geht deutlich schneller)
Die Auswertung der erhaltenen Wertepaare kann mathematisch (z.B. mit Excel) oder klassisch graphisch auf Millimeterpapier erfolgen.
graphische Auswertung:
Man überträgt die Werte auf ein passend dimensioniertes Millimeterpapier. Die zugegebenen ml NaOH werden auf der Abszisse (Unterteilung in 0,1 ml) und die pH-Werte auf der Ordinate (Unterteilung in 0,05 pH-Einheiten) aufgetragen und die Punkte dann per Hand zu einer Kurve verbunden. Bei der Titerstellung der Natronlauge (siehe unten) kann der Äquivalenzpunkt bei pH 7,0 angenommen werden oder man verwendet die Mitte des senkrecht ansteigenden Kurvenabschnitts. Bei der Bestimmung von Diclofenac-Na oder Acetat (als Referenzsubstanz) sind die pH-Sprünge wesentlich weniger steil und die Äquivalenzpunkte werden folgendermaßen ermittelt: mit einem Zirkel beschreibt man in die ansteigenden und abflachenden Kurven je einen möglichst gut passenden Kreis ein, was durch Probieren nach kurzer Zeit recht gut gelingt. Die Mittelpunkte der Kreise (markieren!) werden durch eine Hilfslinie verbunden. Dort, wo diese die Titrationskurve schneidet, liegt der Äquivalenzpunkt[2].
mathematische Auswertung:
Der Äquivalenzpunkt einer Titrationskurve ist mathematisch als Wendepunkt der Kurve definiert (bildlich: wo die Richtung der Krümmung sich ändert, wo die Kurve am steilsten ist). Mathematisch-analytisch ist das gleichbedeutend mit dem Maximum (oder bei sinkendem pH: Minimum; allgemein: lokales Extremum) der ersten Ableitung. In einem Maximum liegt ein Plateau vor, folglich ist dort die zweite Ableitung gleich Null. Das kann man sehr gut in Form einer numerischen Interpolation der diskreten Messpunkte umsetzen: um numerisch die erste Ableitung der Kurve in jedem Messpunkt zu errechnen, führt man im Prinzip zuerst einen quadratischen Kurven-Fit durch drei aufeinanderfolgende Punkte durch (den Messpunkt, sowie den unmittelbar vorigen und nachfolgenden; mit 3 Punkten sind die 3 Koeffizienten der quadratischen Gleichung eindeutig bestimmt) und bildet die erste Ableitung jedes dieser Kurven-Fits. Das führt zu einem neuen Set an Datenpunkten die numerisch die erste Ableitung abbilden und um 2 Datenpunkte weniger enthalten als die ursprünglichen Messdaten (zum ersten und letzten kann man den Wert so nicht errechnen). Wiederholt man die gleiche Prozedur nun mit diesem neuen Set, so erhält man die zweite Ableitung - wiederum um 2 Datenpunkte "gekürzt". Um die Nullstellen zu ermitteln, muss man nun nur noch durch alle aufeinanderfolgenden Paare von 2 Datenpunkten dieses dritten Sets von denen einer größer und der andere kleiner als 0 ist eine lineare Interpolation legen und hat somit - so exakt wie nur möglich - genau die Nullstellen der 2. Ableitung = die Maxima der ersten Ableitung = die Wendepunkte der Titrationskurve = die Äquivalenzpunkte.
Was so formell beschrieben sehr sperrig und kompliziert klingt, ist in einer Tabellenkalkulation mit überschaubaren Formeln leicht abzubilden. Hat man sich erst mal ein Vorlage-Blatt geschrieben, kann man darin beliebige Titrationskurven erfassen und erhält sofort die Auswertung (ggfs. auch inklusive Grafik, wenn man sich das so einrichtet). Abgesehen von der komfortablen sofort-Auswertung hat das Verfahren gegenüber "klassischen" Titrationen mit Indikator noch einen wesentlichen Vorteil: auch wenn man den Äquivalenzpunkt nicht ganz genau trifft, kann man den "wahren" Äquivalenzpunkt durch die Interpolation nachträglich mit sehr hoher Genauigkeit ermitteln. Durch die implizite Mittelung beim Kurven-Fit durch 3 Punkte werden auch kleinere Ablesefehler der Bürette ein wenig herausgemittelt und man erreicht eine Präzision, wie man sie durch direktes Ablesen nur eines Wertes nie erreicht hätte. Weiters kann man auch bei sehr schleifenden "Sprüngen" wie sie bei schwachen Säuren/Basen gerne vorkommen und bei denen die Erkennung der richtigen Indikatorfarbe nur noch Glücksspiel ist, immer noch exakte Aussagen treffen. Der dritte Vorteil einer aufgenommenen Messkurve und mathematischer Auswertung ist schließlich, dass auch "Anomalien", die das Auge gerne mal ignoriert, einer wissenschaftlich exakten Auswertung zugeführt werden. Ob z.B. die NaOH tatsächlich (hinreichend) carbonatfrei war, ob nur ein Analyt vorliegt oder noch etwas Anderes daneben, kann man am Auftreten (oder Fehlen) eines zweiten "Peaks" in der Auswertung sofort erkennen.
Titerstellung der 0,1 N Natronlauge:
10,0 ml der genau 0,1 N Salzsäure werden mit 40 ml Methanol versetzt und mit der einzustellenden 0,1 N Natronlauge titriert. Am Äquivalenzpunkt wird die Natronlauge in 0,1 ml-Schritten zugesetzt.
Die dazugehörige Titrationskurve sieht gezeichnet so aus:
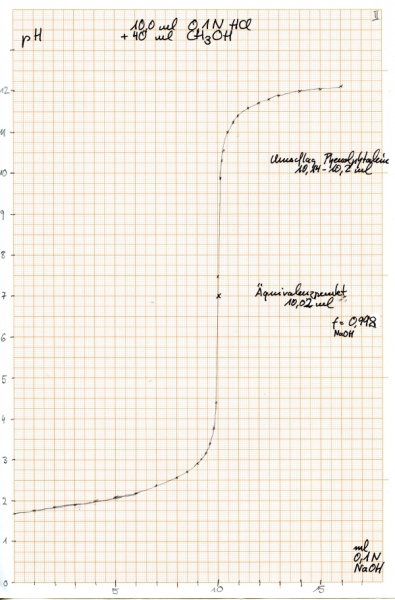
Der Äquivalenzpunkt liegt graphisch bestimmt bei 10,02 ml NaOH, diese hat damit einen Faktor von 0,998. Diese Werte sind natürlich mit einem gewissen Ablesefehler versehen, da die x-Achse nur in 0,1 ml unterteilt ist. Aber mit Hilfe einer Lupe lässt sich die Ablesung dennoch ziemlich genau machen:
Interessant ist dass der zugesetzte Indikator (Phenolphtalein, 3 Tropfen einer 1%igen Lösung) erst bei 10,14 ml eine erste, sehr zarte, Rosafärbung erkennen ließ, die erst bei 10,2 ml deutlicher wurde. Der Indikator zeigt also einen späteren Äquivalenzpunkt an, als die Potentiometrie.
Bestimmung von Acetat als Vergleichssubstanz:
Als “Urtitersubstanz“ kann analysenreines Natriumacetat-Trihydrat (Molmasse: 136,07 g/mol) eingesetzt werden. Davon werden ca. 75 mg, genau gewogen, in 40 ml Methanol und 10,0 ml 0,1 N Salzsäure gelöst und wie beschrieben potentiometrisch titriert. Die Kurve beginnt schon nach 1,5-2 ml NaOH anzusteigen, weswegen die Titrationsschritte verkleinert werden müssen. Es findet sich ein erster Äquivalenzpunkt um ca. pH 4 herum. Beim zweiten, um 10 ml zu erwartenden, Äquivalenzpunkt muss bei der Titration wegen der langsamen pH-Einstellung viel Geduld aufgebracht werden. Titrationsschritte von 0,2 ml sind ausreichend. Bei der Zugabe der letzten Aliquote NaOH geht die pH-Einstellung wieder viel schneller. Ein Milliliter 0,1 N Natronlauge entspricht 13,61 mg der Analysensubstanz.
Konkret wurden 77,0 mg CH3COONa + 3 H2O eingesetzt (0,5658 mmol) und folgende Kurve erhalten:
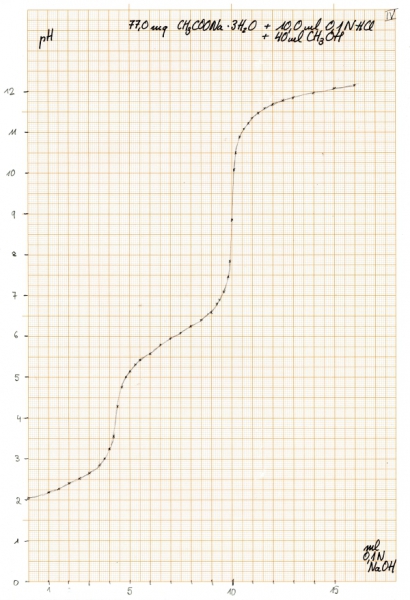
Und wo liegen hier die Äquivalenzpunkte? Mit der oben beschriebenen Methode lassen sie sich folgendermaßen ermitteln:
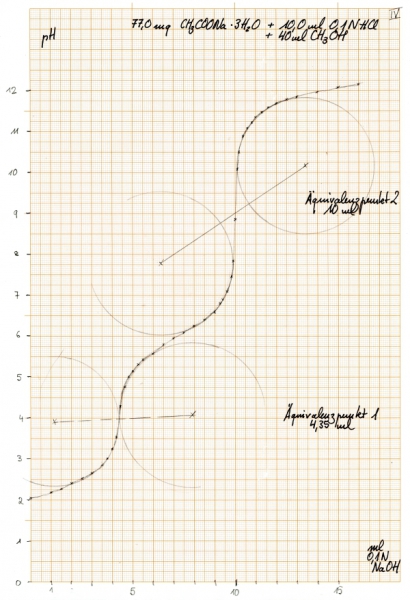
Als Äquivalenzpunkte werden gefunden: 4,35 ml und 10 ml. Der zweite Äquivalenzpunkt ist mit dem bei der Titerstellung gefundenen identisch, was bedeutet, dass keine weiteren sauren Äquivalente im Spiel waren. Die Differenz der Äquivalenzpunkte beträgt 5,65 ml entsprechend 0,565 mmol.
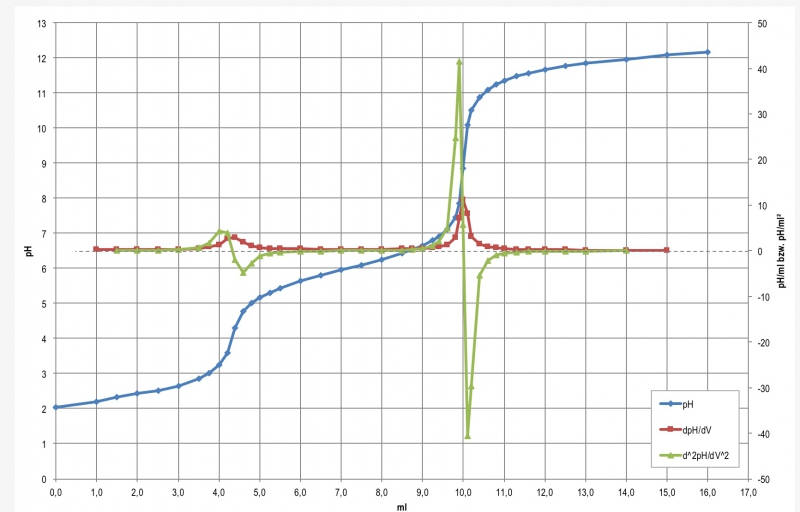
Die gemessene Kurve nebst numerisch ermittelter erster Ableitung sieht so aus:
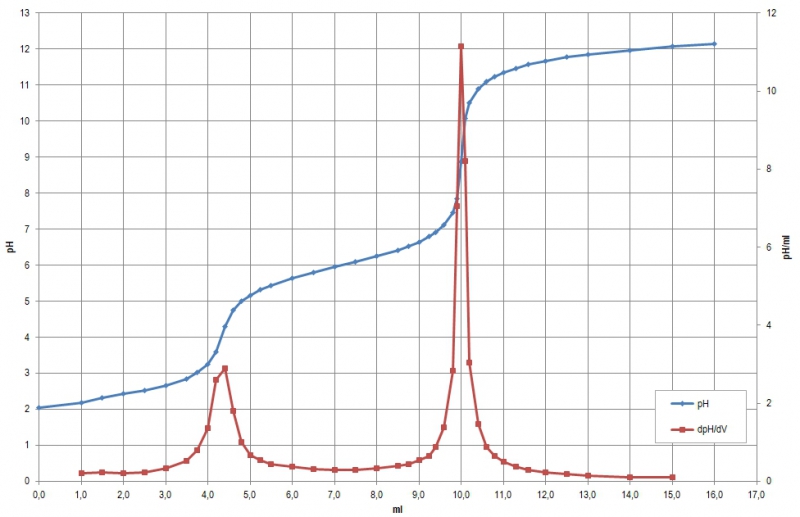
Hier werden die Äquivalenzpunkte zu 4,33 ml und 10,01 ml gefunden. Das entspricht einer Differenz von 5,68 und damit 0,568 mmol.
Der Erwartungswert aufgrund der Einwaage sowie die mit den beiden Verfahren aus der Kurve ermittelten Gehalte fallen um lediglich 0,18% auseinander, was die große Präzision des Verfahrens schön anschaulich macht!
Bestimmung von Diclofenac-Natrium in einem Arzneimittel:
Die zu analysierenden Tabletten werden gepulvert und ein einer kleinen Soxhlet-Apparatur mit 50 ml Methanol erschöpfend extrahiert, was rund 3 Stunden in Anspruch nimmt. Der methanolische Extrakt (ca. 40 ml) wird direkt zur Analyse verwendet. Er wird mit 10,0 ml 0,1 N Salzsäure versetzt und ebenso wie bei Natriumacetat beschreiben potentiometrisch titriert. Auch hier sind die Titersprünge bei 4-5 ml und bei ca. 10 ml zu erwarten und nicht steil. Die Einstellung des pH-Wertes dauert insbesondere beim zweiten Äquivalenzpunkt mehrere Minuten. Ein Milliliter 0,1 N Natronlauge entspricht 31,81 mg Diclofenac-Natrium.
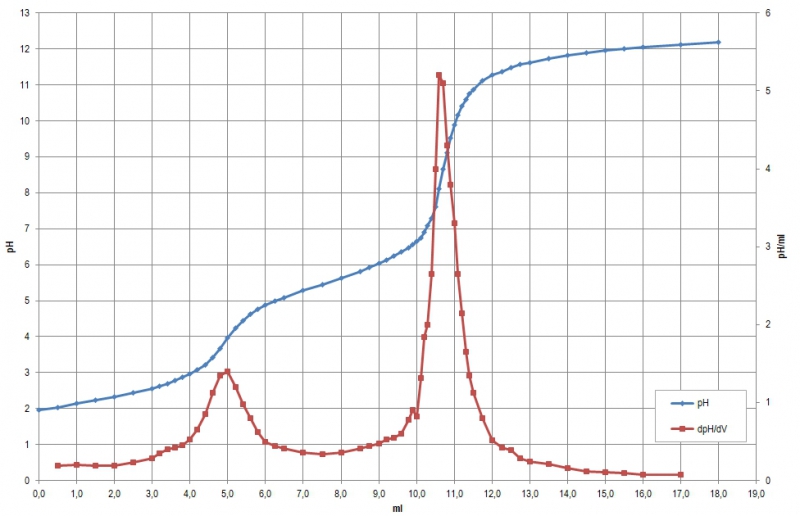
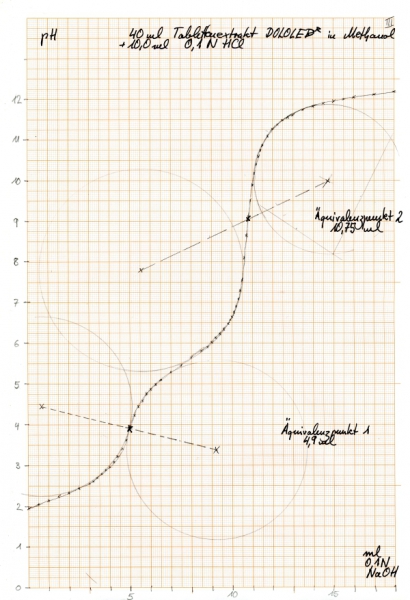
Zur Analyse kamen drei Tabletten DOLOLEDR, eines angeblichen Phytopharmakons, in dem durch qualitative Analyse die Anwesenheit von Diclofenac Natrium (M= 318,1 g/mol) nachgewiesen worden war. Das Gesamtgewicht der gepulverten Tabletten betrug 1735 mg. Die Titrationskurve sah folgendermaßen aus:
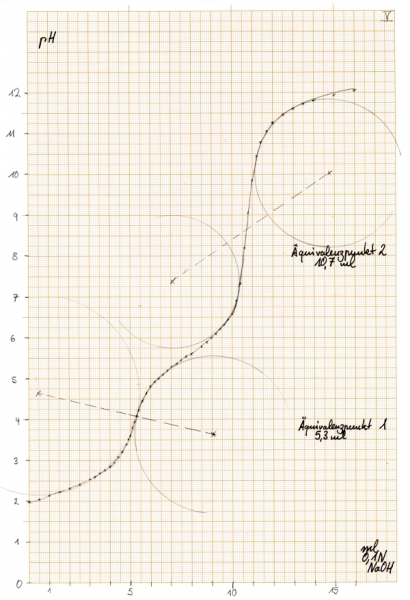
bzw. in mathematischer Auswertung:
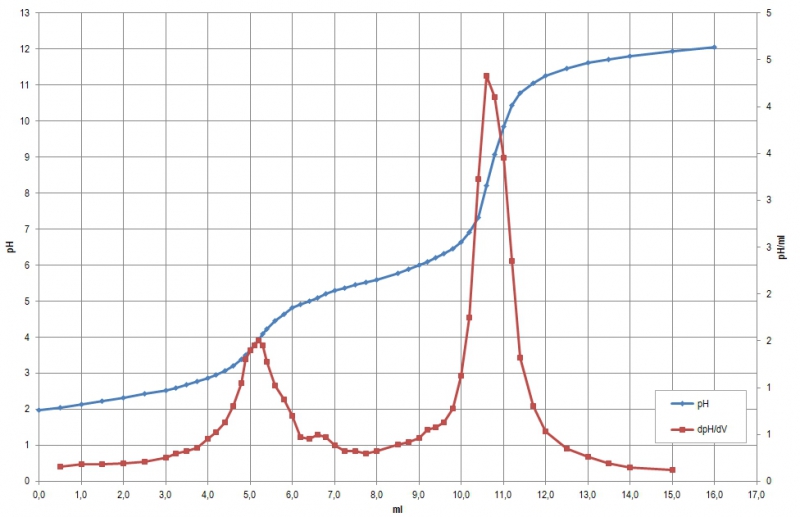
Die Äquivalenzpunkte liegen nach der graphischen Auswertung bei 5,3 und 10,7 ml, mathematisch bei 5,2 und 10,66 ml. Im Gegensatz zum Natriumacetat liegt der zweite Äquivalenzpunkt etwas weiter rechts, was darauf schließen lässt, dass weitere saure Äquivalente vorhanden sind (zur Diskussion und Auswertung siehe unten bei “Erklärungen“). Die mathematische Auswertung deckt hier außerdem eine Unsauberkeit in der Titrationskurve auf: bei einem pH von 6,6 hat die Kurve einen kleinen "Buckel", obwohl dort gar keiner hingehört. (Falsch abgelesen? Falsch notiert? anderes Anion einer schwachen Säure anwesend?)
Entsorgung:
Die austitrierten Lösungen werden mit den halogenfreien organischen Abfällen entsorgt. Überschüssige Titerlösungen können dem Abwasser zugeführt werden.
Erklärungen:
Versetzt man das Salz einer schwachen Säure – hier als Beispielsubstanz Natriumacetat – mit überschüssiger Salzsäure, so wird das Anion praktisch vollständig protoniert und das Reaktionsgleichgewicht
HCl + CH3COONa ↔ NaCl + CH3COOH
liegt zu >99 % auf der rechten Seite. Zu Beginn der Titration enthält die Analysenlösung daher Essigsäure, Natriumchlorid und überschüssige Salzsäure. Während der Titration wird zunächst die Salzsäure verbraucht und der erste pH-Sprung (Äquivalenzpunkt) tritt auf, wenn diese verbraucht ist und nunmehr die saure Reaktion nur noch durch die viel schwächere Essigsäure (pKs = 4,76) bestimmt wird. Diese wird dann weiter titriert, bis der zweite Äquivalenzpunkt erreicht wird, an dem die Lösung nur noch Natriumacetat (neben Natriumchlorid) enthält. Die Differenz zwischen den beiden Punkten ergibt die vorhandene Menge an Acetat in der Probe.
Diclofenac ist ebenfalls eine schwache organische Säure, deren pKs Wert mit 4,2 dem der Essigsäure vergleichbar ist[3]. Es trägt die systematische Bezeichnung 2-{2-[(2,6-Dichlorphenyl)amino]phenyl}essigsäure
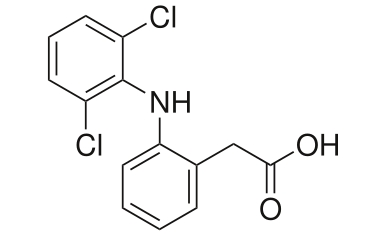
Molmasse Diclofenac: 296,1 g/mol
Molmasse Diclofenac-Natrium: 318,1 g/mol
De Titration entspricht genau dem Vorgehen bei der Bestimmung von Acetat. Man erhält die Menge an vorhandenem Diclofenac-Natrium durch die Differenz zwischen dem ersten und dem zweiten Äquivalenzpunkt. Sowohl Diclofenac als auch sein Natriumsalz sind in Methanol löslich (letzteres zu ca. 3 g/100 ml[3]). Die relativ hohe Methanolkonzentration ist notwendig, um ein Ausfallen der freien Säure zu verhindern. (Die klare methanolische Lösung wird nach Zusatz der Salzsäure zwar leicht trübe, dies ist jedoch nicht durch Diclofenac bedingt, da die Trübung auch bei Zusatz von Wasser auftritt und sich durch Alkalisieren nicht wieder beseitigen lässt). Das Methanol drängt die Dissoziation zurück, wodurch der Umschlag von Phenolphtalein (nur das dissoziierte Anion ist rot gefärbt) etwas verzögert auftritt. Die Titerstellung ist daher besser durch Potentiometrie vorzunehmen.
Warum trat der zweite Äquivalenzpunkt bei der Titration des Diclofenac-Natriums verspätet auf? Die Tabletten enthalten als Grundsubstanz mikrokristalline Zellulose sowie ein nicht näher bestimmtes Bindemittel auf Kohlenhydratbasis (z.B. Agar, arabisches Gummi, Carboxymethylcellulose etc.). Diese unlöslichen polymeren Kohlenhydrate enthalten freie COOH-Gruppen. Während der Extraktion könnte aus diesen und einem Teil des Diclofenac-Natriums freies Diclofenac entstanden sein. Solange keine methanollöslichen sauer reagierenden Stoffe zugegen sind tut dies der Bestimmung jedoch keinen Abbruch. Unter dieser Annahme kann – am Beispiel der mathematischen Auswertung - folgende Berechnung angestellt werden:
Diclofenac-Natrium: 10,01 - 5,3 = 4,71 mmol
Diclofenac-Säure 10,66 - 10,01 = 0,65 mmol
Fasst man beides als Diclofenac-Natrium zusammen so ergibt sich ein Gehalt von 5,36 mmol = 170,5 mg, also durchschnittlich 56,8 mg pro Tablette oder 9,8 % des Tablettengewichts.
Nähme man dagegen an, dass andere lösliche saure Substanzen zugegen sind, so müsste man den Gehalt von Diclofenac-Natrium zu 0,471 mmol = 149,5 mg oder im Durchschnitt 49,8 mg pro Tablette (8,6 % vom Tablettengewicht) berechnen.
Zusammengefasst bietet die hier vorgestellte Methode den Vorteil, mit relativ geringem apparativem Aufwand und unter Anwendung üblicher Maßlösungen in wässrigem Medium arbeiten zu können. Die Ergebnisse sind offenbar hinreichend genau und man muss nicht wie bei der Arzneibuchvorschrift (Titration mit Perchlorsäurelösung in wasserfreier Essigsäure) eine extra mit Essigsäure imprägnierte Glaselektrode bereithalten. Nachteilig ist lediglich der höhere Zeitaufwand.
Bilder:

Kalibrierung der pH-Elektrode

Potentiometrische Titration
Literatur:
1. Europäisches Arzneibuch, 9. Ausgabe
2. Poethke, Walter: Praktikum der Massanalyse; 2. Auflage 1980, Verlag Harri Deutsch, Thun und Frankfurt/Main; ISBN 3-87144-535-5
3. Clarke's Analysis of Drugs and Poisons, 4th Edition 2011; Pharmaceutical Press London-Chicago; ISBN 978 0 85369 711 4