Die Bestimmung des gelösten Sauerstoffs in Wasser erfolgt heute in der Regel komfortabel durch entsprechende Sauerstoff-Elektroden (z.B. Clark-Elektrode) die auch einen Einsatz "im Feld" ermöglichen. Die Winkler-Methode wurde bereits 1888 von Lajos (deutsch: Ludwig Wilhelm) Winkler entwickelt und beruht auf der Oxidation von Mangan-(II)-hydroxid durch den gelösten Sauerstoff zu Mn+3 das anschließend durch eine Titration bestimmt wird. Die Methode ist in Form der "DEV G-21 – Bestimmung des gelösten Sauerstoffs – Iodometrisches Verfahren" nach wie vor der Referenz-Standard zur Sauerstoffbestimmung.
Die größte Herausforderung dabei besteht im Handling der Probe – wie schafft man es, eine Wasserprobe so zu nehmen und zu behandeln, dass dabei keine Verfälschung durch Luftblasen auftritt? Zur Bestimmung dient dabei eine sogenannte "Winkler-Flasche": Das ist im Wesentlichen eine Steilbrust-Flasche mit Schliffstopfen mit genau definiertem Volumen. Befüllt werden sollte sie idealerweise mit einem Schlauch odgl. vom Boden her, damit nicht beim Befüllen die verdrängte Luft im Wasser gelöst wird und damit den Messwert verfälscht. Auch die Reagenzienzugabe erfordert etwas Geschick – die Lösungen müssen auf den Boden der Flasche pipettiert werden sodass überschüssiges Wasser oben abfließt bevor die Flasche mit dem Glasstopfen – ohne Einschluss von Luftblasen - verschlossen wird.
Ein etwas einfacherer und durchaus auch "feldtauglicher" Ansatz ist hier, mit Spritzen zu arbeiten. Das Befüllen ohne Luftblasen ist mit ein wenig Übung relativ problemlos möglich und auch die Zugabe von Reagenzien bereitet keine größeren Schwierigkeiten.
Geräte:
(Einweg-)Spritzen 50 ml und 20 ml, Kanüle, Titrierkolben, Waage (Optional: Bürette)
Chemikalien:
Mangan(II)-sulfat



Kaliumiodid
Natriumhydroxid
Phosphorsäure
Natriumthiosulfatlösung 0,01 N
Stärke
optional:
Natriumazid
Durchführung:
Reagenzlösungen:
Winker Reagenz I: Mangansulfat ca. 2 mol/l (33,8 g MnSO4.H2O zu 100 ml auflösen)
Winker Reagenz II: Natriumhydroxid ca. 6 mol/l + Kaliumiodid 2 mol/l (24 g NaOH + 33,2 g KI); Optional können hier noch 0,5 g Natriumazid zugesetzt werden um mögliche Fehler durch anwesendes Nitrit auszuschließen.
Winker Reagenz III: 85%ige Phosphorsäure (konzentriert, ca. 14,6 mol/l)
Maßlösung zur Titration: 0,01 N Natriumthiosulfat, eingestellt
Die 50 ml Spritze wurde durch Befüllen mit dest. Wasser bis exakt zur 50 ml Marke, entleeren und wiegen der Differenz zuerst "ausgelitert" um eine möglichst große Genauigkeit zu erzielen. In diesem Fall ergab sich dabei ein Volumen von 49,50 ml mit einer Wiederholgenauigkeit von +/- 0,1 ml.
Zur Probennahme befüllt man die 50 ml Spritze zweckmäßigerweise am besten durch mehrfaches Befüllen und rasches Entleeren unter Wasser sodass allfällige Luftblasen gut ausgestoßen werden. Zur endgültigen Probennahme zieht man das Wasser dann langsam und bis über die Marke auf. Nun wird eine Kanüle aufgesetzt – diese hilft einerseits beim Aufsaugen der Reagenzien, andererseits stellt sie einen weiteren Schutz vor Eindringen von Sauerstoff bzw. ungeplantem Ausfließen von Flüssigkeit dar. Jetzt kann das Wasser wieder bis genau zur Markierung ausgestoßen werden.
Als nächstes werden zuerst ca. 2 ml Winker Reagenz I aufgesogen und durch leichte Bewegungen in der Flüssigkeit etwas verteilt. Dann werden ca. 2 ml Winker Reagenz II aufgesogen und ebenfalls durch leichte Bewegungen in der Flüssigkeit etwas verteilt. Dabei kommt es zur Ausscheidung von Manganhydroxid, das sich bei Anwesenheit von Sauerstoff rasch braun verfärbt. Sollen Probennahmen "im Feld" erfolgen, wo nicht sofort titriert werden kann, dann ist die Probe in diesem Zustand aufzubewahren – der Sauerstoff ist jetzt „fixiert“ und kann nicht mehr durch Biologische Prozesse anderweitig verbraucht werden.
Nach ein paar Minuten Wartezeit, in der das Hydroxid immer wieder durch leichte Bewegungen in der Flüssigkeit gut verteilt wird, wird die Kanüle abgenommen und es werden rasch 2-3 ml der konz. Phosphorsäure (Winker Reagenz III) aufgesogen und ebenfalls verteilt. Das Abnehmen der Kanüle ist hier erforderlich, da die Phosphorsäure zu sirupös ist und nur sehr schwer durch die Kanüle aufgesogen werden kann. Sobald die Phosphorsäure zugegeben ist, ist das System auch nicht mehr so empfindlich gegen Luftsauerstoff – die Oxidation von Iodid durch Luftsauerstoff im schwach Sauren erfolgt nur sehr langsam.
Dennoch sollte nun rasch titriert werden, um eine Verfälschung der Ergebnisse entweder durch Oxidation von Iodid oder durch Iod-Verlust zu vermeiden. Der Inhalt der Spritze wird dazu in einen 100 ml Titrierkolben gegeben und die Spritze zweimal mit etwas dest. Wasser nachgespült, das ebenfalls in den Titrierkolben kommt.
Die Titration selbst wurde konsequenterweise ebenfalls mithilfe einer Spritze gravimetrisch durchgeführt. Dazu wurde eine 20 ml-Spritze mit der Thiosulfatlösung befüllt, die Kanüle aufgesetzt, auf der Waage tariert und nach Ende der Titration - unter Verwendung von Stärkelösung als Indikator - die Gewichtsdifferenz (entspricht in guter Näherung dem Volumen) abgelesen. Diese Arbeitsweise hat sich als besonders rasch und einfach erwiesen und spart gegenüber der Arbeit mit Bürette einerseits Zeit (befüllen, ablesen, rascheres Entleeren bis nahe zum Äquivalenzpunkt), andererseits ermöglicht sie ein maximal genaues Arbeiten (sehr kleine Tropfen dosierbar, sehr „gefühlvolles“ Dosieren möglich gegen Ende der Titration). Natürlich kann hier auch eine konventionelle, volumetrische Bürette eingesetzt werden.
Eine gewisse Herausforderung stellt die Ermittlung eines Reagenzienblindwerts dar, denn Reagenzlösungen können Sauerstoff und andere oxidierend wirkende Substanzen enthalten, die den Messwert verfälschen. Luftsauerstoff ist ständig präsent – zumindest wenn man nicht eine Glovebox mit Inert-Atmosphäre hat. Auch das Abkochen oder Belüften mit N2 sind keine Garanten für sauerstofffreies Wasser. Nach einigen Tests hat sich die folgende Methode als einfach und praktikabel erwiesen: Man kocht Wasser ca. 10-15 Minuten lang über Magnesium-Spänen ab. Dabei wird sowohl durch das Kochen gelöster Sauerstoff ausgetrieben als auch Reste von Sauerstoff durch Reduktion entfernt, ohne dass dabei Stoffe eingetragen werden, die bei den nachfolgenden Redox-Reaktionen stören würden. Zur Probennahme wird das noch kochende Wasser direkt in die Spritze eingefüllt und die Spritze mit der Spitze nach unten in der Flüssigkeit auskühlen gelassen sodass beim Auskühlen nur sauerstofffreies Wasser nachströmen kann. Der so ermittelte Reagenzienblindwert betrug 0,73 ml einer 0,01 N Thiosulfatlösung (Titer = 1,008), bei 49,5 ml Probenvolumen entspricht das immerhin 1,2 mg/l O2!
Folgende 6 Proben wurden gemessen:
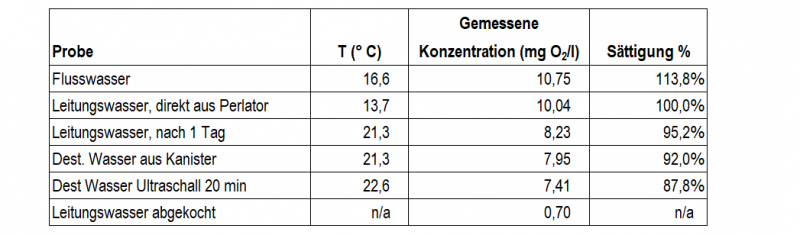
Die Sättigung wurde dabei im Verhältnis zum druck- und temperaturabhängigen Gleichgewichtswert errechnet der in einschlägigen Tabellen nachzulesen ist. Der Faktor "Druck" wurde dabei nicht berücksichtigt und Sättigung bei Normaldruck zum Vergleich herangezogen.
Das Flusswasser entstammt einem kleinen Fluss bei mir in der Nähe und wurde an einem sonnigen Frühlingstag entnommen. Durch die biologische Aktivität von Algen kann dabei durchaus der Sättigungswert merklich über 100% steigen! Hier ein publiziertes Beispiel:
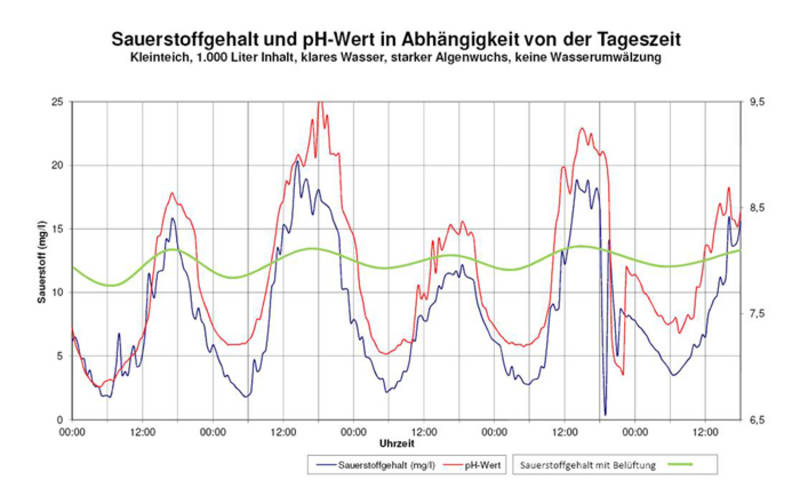
(Quelle)
Leitungswasser das aus einem sog. "Perlator"-Wasserhahn ausströmt, zeigte eine genau 100% Sättigung. Da es beim Austreten sehr stark aufgeschäumt wird hat es viel Möglichkeit zum Gasaustausch – der Wert erscheint daher plausibel.
Nach 1 Tag stehen waren die üblichen Gasbläschen zu sehen – gelöste Luft ist ausgeperlt. Das ist vor allem durch das Ansteigen der Temperatur zu erklären, parallel dazu dürfte es aber auch einen anderen, sauerstoffzehrenden Prozess geben, denn der Sättigungswert war mit 95,2% leicht gesunken, was durch reines Ausgasen nicht erklärbar wäre! Destilliertes Wasser aus dem Kanister hatte einen sehr ähnlichen Sättigungswert.
Behandlung mit Ultraschall soll durch Kavitation auch das Ausgasen von Sauerstoff bewirken – eine 20-Minütige Behandlung des dest. Wassers aus dem Kanister in meinem Ultraschallbad brachte jedoch nur eine geringe Reduktion.
Abgekochtes Wasser (ca. 1 Liter im Wasserkocher 3 x bis zum Sieden erhitzt) war zwar erwartungsgemäß schon weitgehend von Sauerstoff befreit, hatte aber immer noch einen Restgehalt von 0,7 mg/l.
Die Versuche zeigen jedenfalls klar, dass Arbeiten unter Sauerstoffausschluss gar nicht so leicht zu bewerkstelligen ist!
Entsorgung:
Abfälle kommen zu den schwermetallhaltigen Abfällen.
Erklärung:
Im ersten Schritt erfolgt die Bildung von weißem, unlöslichem Mangan-(II)-Hydroxid aus dem zugesetzten Mangansulfat und Natronlauge:
Mn+2 + 2 OH- → Mn(OH)2
Mangan-(II)-Hydroxid ist sehr leicht zu braunem Mangan-(III)-Hydroxid oxidierbar:
4 Mn(OH)2 + O2 +2 H2O → 4 Mn(OH)3
Praktisch kommt es auch zur Bildung höherer und gemischter Hydroxide und Oxide wie Mn(OH)4, MnO(OH)2, MnO2. Nach dem Ansäuern oxidieren diese das vorhandene Iodid nach:
2 Mn(OH)3 + 2 I- + 6 H+ → 2 Mn+2 + 6 H2O + I2
Das ausgeschiedene Iod wird dann mit Natriumthiosulfat zurücktitriert nach:
I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6
In Summe entspricht also 1 mol O2 4 mol Thiosulfat – 1 ml einer 0,01 mol/l Thiosulfatlösung somit 0,08 mg O2.
Bilder:
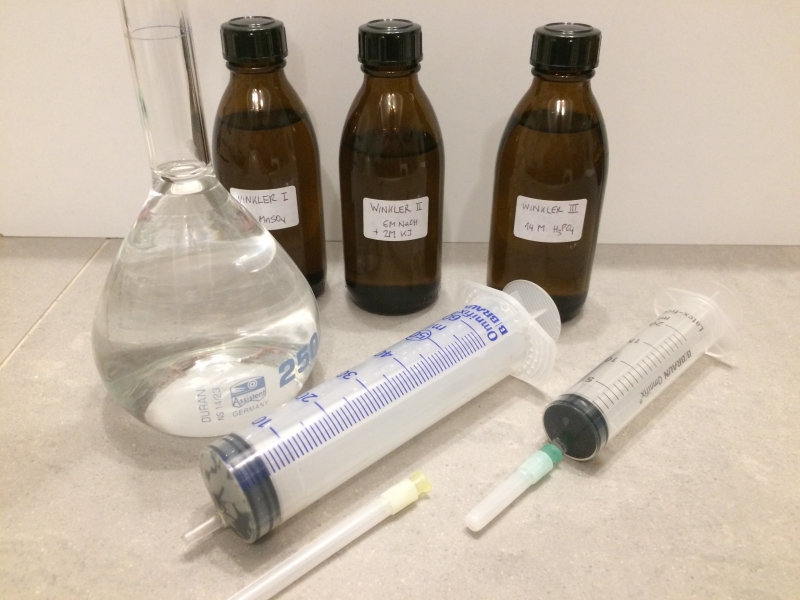
Das "Set" der Reagenzien und Geräte

Spritze mit ausgeschiedenem, bereits oxidiertem Manganhydroxid

Nach der Zugabe von Phosphorsäure

Titration des Iods
Literatur:
[1] Lajos Winkler, Berichte der Deutschen Chemischen Gesellschaft., 1888 (21), Nr. 2, p. 2843–2855