Angeregt durch divese Literaturfunde habe ich mich ein bisschen mit der recht einfachen Synthese und den Eigenschaften von Vanillin-Azin beschäftigt. Eine Anwendungsmöglichkeit dieses Stoffs liegt in der Bildung farbiger Komplexe mit verschiedenen Metallen, dabei sind vor allem der dunkelrote Zink- und der hellrote Blei-Komplex als analytisch nutzbar hervorzuheben.
Geräte:
Reagenzgläser, Glasstäbe, Pipetten, Uhrglas, Filterpapier
Chemikalien:
Vanillin-azin

Bleinitrat
Zinkchlorid
Natronlauge
Salzsäure
Essigsäure
Durchführung:
a) als Tüpfeltest:
1 %ige Na-Vanillin-Azin Lösung: 100 mg Vanillin-Azin wurden mit 0,8 ml 1M NaOH und wenigen ml Wasser unter leichtem Erwärmen gelöst und die Lösung auf 10 ml aufgefüllt. Die intensiv gelbe Lösung ist nicht beständig und muß frisch zubereitet werden, an der Luft verfärbt sie sich beim Stehen innerhalb weniger Tage braun (im Reagenzglas ist schön zu beobachten wie die Verfärbung sich von oben nach unten fortsetzt.)
Mit einer Pipette wurden auf Filterpapier Tropfen der Na-Vanillin-Azin Lösung aufgebracht. Nachdem sich die Lösung verteilt hatte und das Papier nicht mehr tropfnass war, wurde auf den noch feuchten Fleck mit dem Glasstab jeweils ein Tröpfchen einer 30 mM und einer 3 mM leicht salzsauren ZnCl2-Lösung bzw. auf einem zweiten Filterpapier einer 30 mM und einer 3 mM leicht essigsauren Pb(NO3)2-Lösung aufgebracht. Bei der 30 mM Lösung bildete sich sofort nach dem Auftropfen ein intensiver roter Ring um die Auftropf-Stelle. Bei der 3 mM Lösung bildet sich der Ring etwas langsamer und schwächer, ist aber immer noch deutlich zu sehen, vor allem nach dem Trocknen des Papiers. Bei Zn ist der Ring aufgrund der etwas dunkleren Farbe des Komplexes etwas deutlicher zu sehen als bei Pb.
Abschätzung der Empfindlichkeit: 1 Tropfen = ca. 50 µl einer 3 mM Lösung enthält ca. 10 µg Zn bzw. ca. 30 µg Pb. Von den in der Literatur angegebenen 0,3 µg für Zn ist das noch mehr als eine Zehnerpotenz entfernt. Die Reaktion fiel unter den beschriebenen Bedingungen aber bereits so schwach aus, dass ein Versuch mit noch geringerer Konzentration als 3 mM nicht sinnvoll erschien. Am pH-Wert dürfte es eher nicht liegen, da sich auf dem Papier zwischen alkalischer Vanillin-Azin-Lösung und leicht saurer Metallsalz-Lösung immer eine Zone mit passendem pH ausbildet. Ggfs. gibt es im original-Paper entsprechende Hinweise.
Da Vanillin-Azin auch mit anderen 2- und 3-wertigen Metallen teils farbige Komplexe bildet, wurde mit einer Lösung von ein paar Kriställchen der entsprechenden Salze in wenigen ml dest. Wasser noch die Querempfindlichkeit auf ein paar andere Ionen getestet. Die Ergebnisse:
Fe3+: Braun-Violetter Ring
Cu2+: Braun-Roter Fleck
Cd2+: Hellbraun-oranger Fleck
Co2+: ganz schwacher hellbraun-oranger Fleck
Ni2+, Cr3+: keine erkennbare Reaktion
Die Färbungen dieser Ionen sind jedenfalls deutlich von Zn und Pb unterscheidbar.
b)als Fällung:
In einem Mikro-Reagenzglas wurden jeweils 2-3 ml einer 30 mM und einer 3 mM leicht salzsauren ZnCl2-Lösung vorgelegt sowie in einem dritten Glas als Blindprobe dest. Wasser. Es wurde ein Tropfen der 1 %igen Na-Vanillin-Azin Lösung zugesetzt. Dann wurde tropfenweise 0,1 M NaOH zugegeben, bis ein Niederschlag von Zn(OH)2 zu beobachten war. In der 30 mM Lösung färbte sich dieser Niederschlag anfangs nur leicht rötlich, innerhalb weniger Minuten wurde er aber tief dunkelrot und setzte sich gut am Boden ab. In der 3 mM Lösung war zwar auch eine leichte Ausfällung beobachtbar, diese färbte sich aber auch nach längerem Stehen nicht rot und setzte sich auch nicht wesentlich ab. Warum bei der 3 mM Lösung der Nachweis (wiederholt) trotz einer erkennbaren Fällung versagt und es zu keiner Färbung kommt, war nicht nachvollziehbar. Vermutlich war der pH schon etwas zu hoch.
In einem Mikro-Reagenzglas wurden jeweils 2-3 ml einer 30 mM und einer 3 mM leicht essigsauren Pb(NO3)2-Lösung vorgelegt sowie in einem dritten Glas als Blindprobe dest. Wasser. Es wurde ein Tropfen der 1 %igen Na-Vanillin-Azin Lösung zugesetzt. Dann wurde tropfenweise 0,1 M NaOH zugegeben, bis ein weißlich-cremefarbener Niederschlag von Pb(OH)2 zu beobachten war, anschließend wurde mit verd. Essigsäure wieder angesäuert worauf der Niederschlag rasch eine intensiv leuchtend rote Farbe annahm. In der 3 mM Lösung war die Färbung auch deutlich aber nur orange-rot. Da Vanillin-Azin nur im alkalischen wasserlöslich ist, entfärbt sich hier auch die Blindprobe. Grundsätzlich ist das positiv, da ohne die Eigenfärbung des Reagens die Farbigkeit allfälliger Niederschläge besser zu beurteilen ist.
Entsorgung:
Die Lösungen der Metallsalze kommen zu den schwermetallhaltigen Abfällen. Die 1 %igen Na-Vanillin-Azin Lösung kann nach Verdünnen über die Kanalisation entsorgt werden.
Erklärung:
Vanillin-Azin bildet mit zahlreichen Metallionen bei geeignetem pH-Wert gefärbte 1:1 Komplexverbindungen: M2+ + vaz → [M(vaz)]2+
Eine Erwähnung eines einschlägigen Tüpfeltests gibt es zum Beispiel in F. Feigl,V. Anger: Spot Tests in Inorganic Analysis - die Erfassungsgrenze dort wird mit 0,3 µg angegeben, die Literaturreferenz verweist auf ein polnisches Paper von R. Matyja. (Chem. analit. (Warszawa) 8, 437--441 (1963) [Polnisch mit engl. Zus.fass.]) Auf das Journal habe ich leider keinen Zugriff aber ein etwas erweitertes Abstract dazu konnte ich noch finden:
In einem anderen Index fand ich dazu unter anderem auch noch folgenden Eintrag:Die Eigenschaften von Vanillinazin, das sich als empfindliches Reagens zum Nachweis yon Zn2+ bzw. Pb2+ in Gegenwart großier Überschüsse an Mg2+, Ni2+, Al3+ und Cr3+ bzw. deren Gemischen erwiesen hat, beschreibt R. MATYJA. Das Vanillinazin bildet mit einer großen Anzahl yon Metallionen verschiedenartig gefärbte Innerkomplexsalze, die wasserunlöslich und im schwach sauren, neutralen bzw. schwach alkalischen Medium sehr beständig sind; die Komplexverbindungen von Zn2+ (dunkelrot) bzw. von Pb2+ (hellrot) sind in ihrer Färbung von der Mehrzahl der anderen Komplexe (gelborange, gelb, grüngelb) deutlich zu unterscheiden, was besonders bei Tüpfelreaktionen auf Papier wichtig ist. Bei einer Grenzverdünnung von 1:154000 bzw. 1:500000 lassen sich noeh 0,3 µg Zn2+ bzw. 0,1 µg Pb2+ in 0,05 ml Lösung zuverlässig nachweisen; die noch erkennbare Menge Zn2+ neben Mg2+ beträgt 1,6 µg (bei Grenzverdünnung 1:31000), neben Ni2+ 3,3 µg (1:15400), neben Al3+ 16,5 µg (1:3100) und neben Cr3+ 32,5 µg (1:1540); für Pb2+ sind die Werte neben Mg2+ 1,0 µg (1:50000), neben Ni2+ 2,6 µg (1:20000), neben Al3+ 10,0 µg (1:5000) und neben Cr3+ 20,7 µg (1:2500). Der Nachweis wird am einfachsten durch Aufbringen von 1 Tr. der zu untersuchenden Zn2+- bzw. Pb2+-haltigen Lösung auf das vorher mit 0,02 m Lösung des Vanillinazindinatriumsalzes getränkte Papier ausgeführt; bei größeren Zn2+- bzw. Pb2+-Gehalten wird die Bildung eines entsprechend gefärbten Niederschlages, bei geringeren Mengen der betreffenden Kationen die Entstehung eines rotgefärbten Kreises am Rand des Tropfens beobachtet. Das Vanillinazin allein liefert die Farbreaktion als wasserunlösliche Substanz nicht; ebenso verhalten sieh auch dessen Lösungen in Ethanol bzw. in Essigsäure. Die beschriebene Reaktionsfähigkeit zeigt nur sein wasserlösliehes Dinatriumsalz, das dutch Lösen von rein zerriebenem, trockenem Vanillinazin in einer berechneten Menge Natronlauge erzeugt wird. Die Lösungen dieses Salzes, besonders in Konzentrationen über 0,1 m, sind nur in beschränktem Maße beständig und werden nach einigen Tagen dunkel. Die mit den angeführten Kationen gebildeten Farbkomplexe werden durch starke Natronlauge unter Zersetzung gelöst. Allmähliches Ansäuern dieser alkalischen Lösungen ruft die erneute Ausfällung der Komplexe hervor, bis sie im stark sauren Medium unter langsamer Ausfällung des freien Vanillinazins zerlegt werden.
Die Informationen im Abstract reichen leider nicht, um das auszuprobieren. Auf eine quantitive Anwendung habe ich daher (bisher) verzichtet.Zur quantitativen Bestimmung von Zn2+, Pb2+, Al3+ und Cr3+ eignet sieh nach R. MATYJA1 die konduktometrische Titration mit einer Lösung des Dinatriumsalzes von Vanillinazin (I). Es wurde gefunden, dass (I) mit 2- sowie 3-wertigen Ionen im Molverhältnis 1:1 reagiert. Verf. gibt an, dass die ausgearbeitete Methode anderen üblichen Methoden nicht nachsteht. Es wurden auch Analysen an Zn2+-Pb2+ und Zn2+-Al3+-Mischungen ausgeführt. Bei der Zn-Bestimmung wurde ein relativer Standardfehler von 0,2%, bei der Pb-Bestimmung von 0,11% gefunden. Chem. analit. (Warszawa) 8, 533--538 (1963) [Polnisch mit engl. Zus.fass.], Lehrst. allg. Chemie, Agrarhauptschule, Warszawa (Polen).
Bilder:

Die 1 %ige Na-Vanillin-Azin Lösung

Tüpfeltest mit Zink - einmal 30 mM Lösung, einmal 3 mM Lösung, einmal ohne

Tüpfeltest mit Blei - einmal 30 mM Lösung, einmal 3 mM Lösung, einmal ohne

Tüpfeltests anderer Ionen
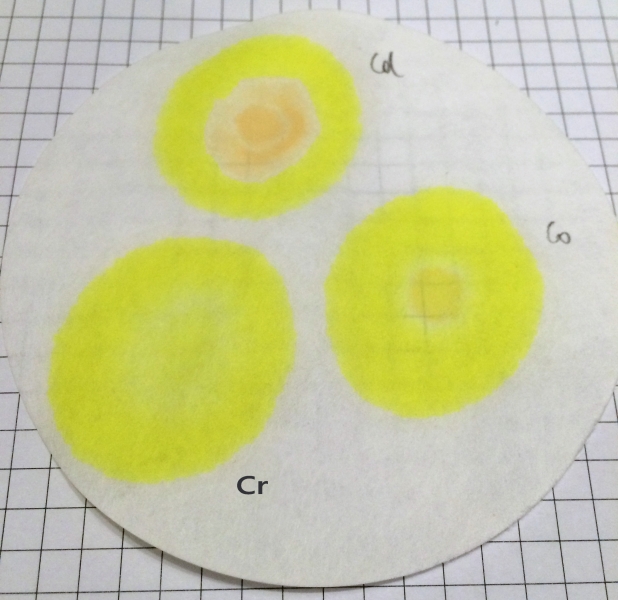
Tüpfeltests anderer Ionen

Fällung mit Zn (vlnr: Blindprobe - 3 mM - 30 mM)

Fällung mit Pb (vlnr: Blindprobe - 3 mM - 30 mM)