Die quantitative photometrische Bestimmung von Nitrit beruht auf seiner Fähigkeit, mit geeigneten organischen Reagenzien intensiv gefärbte Verbindungen – Azofarbstoffe – zu bilden. Im klassischen Nitritreagenz nach Georg Lunge (1839-1923) werden Sulfanilsäure und 1-Naphthylamin eingesetzt. In leicht abgewandelter Form, unter Verwendung von Sulfanilamid und N-(1-Naphtyl)ethylendiamin, ist die Reaktion besonders empfindlich und unter die DIN-Vorschriften zur Wasseruntersuchung aufgenommen worden. Diese Bestimmung lässt sich auch zur Bestimmung Nitrit in Wurstwaren, denen es als Konservierungsstoff zugesetzt wird, anwenden.
Material/Geräte:
Zahlreiche Reagenzgläser, mehrere Erlenmeyerkolben 100 ml, Messzylinder 100 und 25 ml, Messkolben 100 ml, Messpipetten 20 und 10 ml, Kolbenhubpipetten 1000 und 500 µl, Analysenwaage, Becherglas 250 ml, Trichter, Filter, Spektralphotometer, Einmalküvetten (d = 1 cm), Urinteststreifen
Chemikalien:
N-(1-Naphtyl)ethylendiamin-dihydrochlorid


Phosphorsäure 85% (1,71 g/ml)

Sulfanilamid
Versuchsdurchführung:
1. Ansetzen der Reagenzien:
Nitritreagenz: man verdünnt 2,5 ml Phosphorsäure mit ca. 15 ml Wasser und löst darin zunächst 1 g Sulfanilamid und anschließend 50 mg N(1-Naphtyl-)ethylendiamin-dihydrochlorid. Zuletzt wird mit Wasser auf 25,0 ml aufgefüllt. (Das Reagenz ist im Kühlschrank im Dunklen aufbewahrt ca. 1 Monat haltbar)
verdünnte Phosphorsäure: 2,5 ml Phosphorsäure werden mit Wasser auf 25,0 ml verdünnt.
Nitrit-Standardlösung: man löst 300,0 mg Natriumnitrit im Messkolben zu 100,0 ml in Aqua dest. Der genaue Gehalt dieser Lösung (theoretisch 2 mg Nitrit/ml) wird cerimetrisch ermittelt und eine Stammlösung von 1 mg/ml hergestellt. Diese wird mit Aqua dest weiter verdünnt und so Referenzlösungen von 1, 0,5, 0,2, 0,05, 0,02 und 0,01 mg Nitrit/l erhalten. (Die Stammlösung kann durch Zusatz eines Tropfens Chloroform auf 100 ml für einige Tage konserviert werden, die Verdünnungen sind nicht haltbar)
2. Durchführung der Analyse:
Je 20,0 ml der zu untersuchenden Probe werden mit 500 µl Nitritreagenz versetzt. Es stellt sich eine langsam intensiver werdende, rotviolette Färbung ein, die bei normaler Zimmertemperatur nach etwa 10-15 Minuten ihr Maximum erreicht hat und dann für mehrere Stunden stabil bleibt. Man photometriert nach frühestens 15 Minuten bei 540 nm gegen einen Leerwert. Den Leerwert stellt man aus 20 ml der Probe unter Zugabe von 500 µl verdünnter Phosphorsäure her, um Störungen durch eine evtl. Trübung oder Verfärbung der Probe zu kompensieren.
Zur Ermittlung einer Eichgeraden verfährt man folgendermaßen: je 20 ml der Standardlösungen werden mit 500 µl Nitritreagenz versetzt und nach mindestens 15 Minuten Reaktionszeit gegen einen Leerwert photometriert, der aus 20 ml destilliertem Wasser und 500 µl Nitritreagenz hergestellt wird.
Meine Eichmessungen ergaben folgende Werte:
1 mg Nitrit /l : Extinktion 0,9 und 0,91
0,5 mg Nitrit/l : Extinktion 0,48 und 0,475
0,2 mg Nitrit/l : Extinktion 0,19 und 0,188
0,05 mg Nitrit/l : Extinktion 0,52 und 0,5
0,02 mg Nitrit/l : Extinktion 0,02 und 0,021
0,01 mg Nitrit/l : Extinktion 0,01 und 0,011
Nach der Literatur[2] ist ab einer Konzentration von „ca. 1 mg Nitrit/l“ das Lambert-Beer’sche Gesetz nicht mehr gewahrt. Daher fällt die Extinktion bei 1 mg/l geringer aus als erwartet. Proben mit einem die Linearitätsgrenze übersteigenden Gehalt müssen zuvor verdünnt werden. Für die Erstellung der Eichkurve habe ich die Messung der 1 mg/l-Probe daher nicht berücksichtigt.
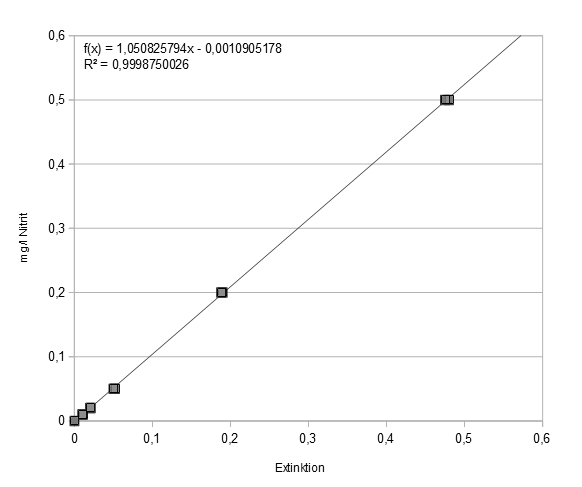
Weil das Reagenz - insbesondere wenn es nicht ganz frisch ist - eine geringe Eigenabsorption aufweist, ermittelt man mit jeder Messreihe die Extinktion einer Mischung von 20 ml Aqua dest. mit 500 µl Nitritreagenz gegen 20 ml Wasser mit Zusatz von 500 µl verdünnter Phosphorsäure. Der so gefundene Wert muss von den Messwerten abgezogen werden
Anmerkung:
Die Analyse kann analog auch mit dem klassischen Lunge-Reagenz ausgeführt werden[3]. Hierzu löst man 65 mg Sulfanilsäure und 10 mg 1-Naphtylamin getrennt in je 20,0 ml 10 %iger Essigsäure und vereinigt die beiden Lösungen. Zu 20,0 ml Wasserprobe gibt man 1 ml Eisessig und 1 ml Lunges Reagenz. Die Farbentwicklung dauert nach meinen Versuchen hier etwa 25 Minuten! Man misst nach 30 Minuten bei 530 nm. Die Reaktion ist aber etwas weniger empfindlich als mit dem oben beschriebenen, modifizierten Nitritreagenz.
3. Ermittlung des Nitritgehaltes in Wurstwaren:
Man wiegt – je nach Nitritgehalt – 10,0 bis 20,0 g der feingeschnittenen, zu untersuchenden Ware ab und verrührt im Becherglas für 5 Minuten mit 100 ml Wasser (Magnetrührer). Danach wird filtriert. Die ersten 20 ml des Filtrates werden verworfen (Nitrit wird teilweise an Zellulose adsorbiert) und im Rest der Nitritgehalt bestimmt. Aus der Konzentration wird auf den Gehalt in 1 kg Lebensmittel hochgerechnet.
Bei den hier dokumentierten Versuchen wurde eine Probe gekochter Schinken und geschnittene Salami untersucht. Je 10 g wurden mit 100 ml Wasser verrührt. Als Leerwert wurde jeweils eine Probe des Extraktes, versetzt mit Phosphorsäure, eingesetzt. Es ergaben sich folgende Messwerte:
Gekochter Schinken: Extinktion 0,315
Das entspricht einer Konzentration von 0,330 mg Nitrit/l, bzw. 3,3 mg Nitrit oder 5 mg Natriumnitrit in 1 kg Schinken.
Salami: Extinktion 0,01
Das entspricht einer Konzentration von 0,01mg Nitrit/l, bzw. 0,1 mg Nitrit oder 0,15 mg Natriumnitrit in 1 kg Salami.
Wegen des sehr geringen Nitritgehaltes der Salami habe ich den Versuch mit der doppelten Menge (20,0 g auf 100 ml) wiederholt und die Extraktion im siedenden Wasserbad (5 Minuten unter Rühren) durchgeführt. Nach dem Abkühlen wurde filtriert. Die Extinktion wurde zu 0,02 bestimmt, was mit dem zuvor gemessenen Wert genau übereinstimmt. Durch die “warme Extraktion“ wurde also nicht mehr Nitrit aus der Salami herausgelöst, als auf kaltem Wege.
Exkurs: Nachweis von Nitrit in Wurstwaren mit Teststreifen
Ein käuflicher Urinteststreifen, der ein Testfeld zum Nachweis von Nitrit enthält, wurde einmal in den wässrigen “Schinkenextrakt“ getaucht und einmal mit dem sich in der Schinkenpackung abscheidenden Fleischsaft benetzt. Beides Mal trat eine Verfärbung des Testfeldes auf, die bei dem wässrigen Extrakt deutlich schwächer ausgeprägt war. Der “Salamiextrakt“ gab keine Reaktion.
Ein anderer Schnelltest sprach dagegen nicht an: selbst der reine “Schinken-Fleischsaft“ gab nach Ansäuern mit Kaliumiodid-Stärke-Papier keine Blaufärbung.
Entsorgung:
Die Lösungen werden über das Abwasser entsorgt.
Erklärungen:
In saurem Milieu bildet Nitrit mit Sulfanilsäureamid eine Diazoniumverbindung, die dann an das N-(1-Naphtyl)ethylendiamin zu einem roten Azofarbstoff kuppelt:

Wenn man sich die Zusammensetzung des Nitritreagenz‘ genauer ansieht fällt auf, dass es einen massiven Überschuss an Sulfanilamid enthält. Dadurch soll verhindert werden, dass Nitrit mit dem N-(1-Naphtyl)ethylendiamin reagieren könnte und so der Farbreaktion entzogen würde. Eine ältere Vorschrift verwendet zwei getrennte Reagenzlösungen, wobei zur angesäuerten Probe zuerst Sulfanilamid und dann N-(1-Naphtyl)ethylendiamin zugegeben wird, und kommt mit einem wesentlich geringeren Verbrauch an Sulfanilamid aus[2]. Wegen der Einfachheit des Vorgehens hat sich aber die hier beschriebene Methode durchgesetzt. Die in Wasser zu bestimmenden Nitritkonztentrationen liegen sowieso meistens deutlich unter 1 mg/l
Nitrit entsteht in der Umwelt durch bakterielle Reduktion von Nitrat und kommt vor allem in Oberflächenwässern vor, da es im Boden stark adsorbiert wird. Nur in Regionen mit massiver Überdüngung kann das Grundwasser nachweisbare Mengen Nitrit enthalten. Sonst ist das Vorkommen der Substanz in der Regel ein Zeichen für eine Verunreinigung mit Fäkalien. Im Trinkwasser ist der Nitritgehalt gesetzlich auf maximal 0,1 mg/l begrenzt.
In der Medizin dient der Nachweis von Nitrit im Urin als Zeichen für eine Infektion der Harnwege mit Nitrit-bildenden Bakterien, allen voran das am häufigsten vorkommende Escherichia coli. Die Bakterien reduzieren das im Urin in Spuren immer vorhandene Nitrat zu Nitrit. Daneben gibt es natürlich auch Harnwegsinfekte, die “Nitrit-negativ“ sind, was verschiedene Ursachen haben kann (nicht-nitritbildende Bakterien, weitere Reduktion des Nitrits zu ammoniak, stark saurer Urin etc.).
Das klassische Nitritreagenz für die Urinuntersuchung nach Griess-Ilosvay (1 ml wird mit 3 ml Urin gemischt) entspricht in seiner Zusammensetzung genau dem Reagenz nach Lunge, nur die Essigsäurekonzentration liegt mit 25 % höher[4]. Die heute verwendeten Teststreifen arbeiten mit Sulfanilamid und Naphthylethylendiamin in einem Tockensystem und bei Anwesenheit von Nitrit läuft die oben geschilderte Reaktion ab.
In der Lebensmitteltechnik wird Natriumnitrit in Form von Nitritpökelsalz (Kochsalz mit einem Zusatz von bis zu 0,5 % NaNO2) zum Haltbarmachen von Fleisch und insbesondere von Wurstwaren verwendet. Das Nitrit erfüllt dabei mehrere Funktionen. Einmal verbindet es sich mit dem roten Muskelfarbstoff Myoglobin zu einem Nitrosoderivat, das (in Analogie zum Carboxy-Hämoglobin) hellrot gefärbt und weitgehend oxidationsresistent ist, so daß das Fleisch eine schöne rote Farbe behält. Zweitens bildet sich ein typisches Aroma heraus, das vom Verbraucher als angenehm empfunden wird (Den Unterschied kann man leicht feststellen, wenn man konventionelle Salami mit Bio-Salami, die ohne Nitrit hergestellt wurde, vergleicht. Letztere ist im Gegensatz zu ersterer schnell graubraun verfärbt und schmeckt auch anders). Weiter entfaltet das Nitrit zusätzlich eine antimikrobielle Wirkung, insbesondere gegen den gefürchteten, toxinbildenden Anaerobier Clostridium butolinum .
Die hier beschriebene Ermittlung des Nitritgehaltes in Salami und Schinken ist eine “Eigenbau-Methode“ und nicht standardisiert (die Methode ist zur Analyse von Wasser entwickelt worden!). Aber größenordnungsmäßig dürfte die Menge an freiem Nitrit damit einigermaßen zuverlässig zu erfassen sein. Die von mir gefundenen Werte liegen mehr als das zehnfache unter den gesetzlichen Grenzwerten, die je nach Lebensmittel 50-175 mg Natriumnitrit/kg betragen. Über die Menge des ursprünglich zugesetzten Nitrits sagt die Analyse natürlich nichts aus, da ein Teil desselben an das Myoglobin gebunden und ein weiterer Teil zu Nitrat oxidiert wurde.
Literatur:
1. Klee, Otto: Wasser untersuchen; Quelle&Meyer-Verlag Wiesbaden, 3. Auflage 1998 (Biologische Arbeitsbücher; 42), ISBN 3-494-01275-X
2. Hütter, Leonard A.: Wasser und Wasseruntersuchung, 1. Auflage 1979; Verlag Mortz Diesterweg/Otto Salle Verlag und Verlag Sauerländer AG; ISBN 3-425-05074-5 (Diesterweg/Salle) ; 4. Auflage 1990 ISBN 3-7935-5075-3 (Salle)
3. Acker, Bergner, Diemair, Heimann, Kiermeier, Schormüller, Souci (Hrsg.): Handbuch der Lebensmittelchemie, Band VIII/Teil 1 – Wasser und Luft; Springer-Verlag Heidelberg-Berlin-New York 1969
4. Hallmann, Lothar: Klinische Chemie und Mikroskopie , 9. Auflage 1960; Georg Thieme Verlag stuttgart
Bilder:

Ansetzen der Reagenzien


Färbung der Standardlösungen bei fallender Nitritkonzentration (v.l.n.r.: 1 - 0,5 - 0,2 – 0,05 – 0,02 und 0,01 mg Nitrit/l)

Die untersuchten Wurstwaren

Abwiegen des Schinkens


Färbung des Nitritreagenz im “Salamiextrakt“ (erstes Reagenzglas ganz links) sowie im “Schinkenextrakt“ (drittes RG von links). Neben des Proben jeweils der Leerwert.

Urinteststreifen mit “Schinkensaft“ (links) bzw. “Schinkenextrakt“ (rechts) benetzt.