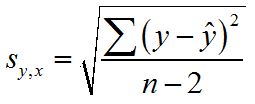Die nephelometrische Bestimmung kleiner Sulfatmengen - z.B. in Wasser - als Bariumsulfat ist sehr störanfällig. Hier wird eine Methode vorgestellt, bei der eine dem Sulfat äquivalenten Menge Chromat photometrisch bestimmt wird. Mengen von 1 - 7 mg SO42- im Versuchsansatz können so exakt erfasst werden.
Material/Geräte:
Analysenwaage, 100 ml-Erlenmeyerkolben, Dreifuß mit Drahtnetz, Brenner, Vollpipetten 20 und 25 ml, Messpipette 10 ml mit Peleusball, Kolbenhubpipette 1000 µl und 20-200µl, Messkolben 500 ml, 100 ml, 50 ml, Zentrifuge, Spektralphotometer, Küvetten (d= 1 cm), Millimeterpapier
Chemikalien:
Salzsäure 1 N

Schwefelsäure 1 N

Ammoniaklösung 25 %


Natriumchlorid
Bariumchromat


zur Darstellung von Bariumchromat ggf.:
Bariumchlorid

Kaliumdichromat



Natronlauge 1 N (carbonatfrei!)

Sicherheitshinweise:
Vorsicht beim Arbeiten mit Chromaten, sie sind karzinogen! Handschuhe tragen!
Versuchsdurchführung:
Reagenzien:
Kochsalz-Lösung (Reagenzlösung 1): 10,0 g Natriumchlorid und 2500 µl 0,1 N Schwefelsäure werden im Messkolben mit dest. Wasser auf 50,0 ml aufgefüllt
Bariumchromatlösung (Reagenzlösung 2): 1 g Bariumchromat wird im Messkolben mit 1 N Salzsäure zu 100,0 ml gelöst, über Nacht absitzen lassen und abgegossen (Haltbarkeit: ca. 4 Wochen)
Sulfat-Standardlösung 1 mg/ml: 2083 µl einer genau 1 N Schwefelsäure (evtl. Titer berücksichtigen!) werden im Messkolben zu 500,0 ml in Aqua dest gelöst.
Vorgehen:
Die zu untersuchende Wasserprobe soll zwischen 1 und 7 mg Sulfat enthalten. Man gibt 20-40 ml davon in einen Erlenmeyerkolben. Dann gibt man genau 2000 µl der Kochsalzlösung (Kolbenhubpipette) und 6 ml der Bariumchromatlösung zu (Messpipette) und erhitzt die Mischung für 5 Minuten zum leichten Sieden. Nach dem Abkühlen gibt man die Flüssigkeit ohne zu filtrieren in den 50 ml-Messkolben fügt 1 ml Ammoniaklösung zu (die Mischung muss alkalisch reagieren – mit Lackmuspapier prüfen!) und füllt mit destilliertem Wasser bis zur Marke auf. Dann zentrifugiert man eine Probe und gießt die überstehende klare Lösung in eine Küvette ab. Man bestimmt die Extinktion bei 430 nm gegen einen Leerwert, der mit 25-30 ml destilliertem Wasser anstelle der Analysenlösung hergestellt wurde.
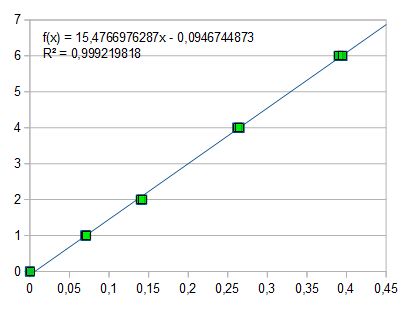
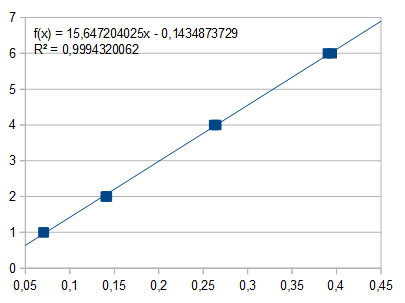
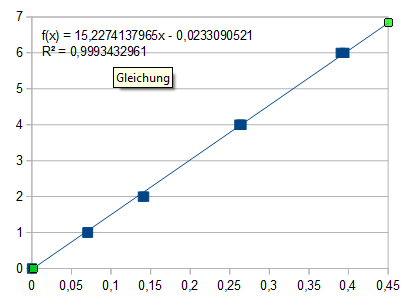
Um eine Eichkurve zu erstellen gibt man je 1000, 2000, 4000 und 6000 µl der Sulfat-Standardlösung (entsprechend 1 mg, 2 mg, 4 mg und 6 mg Sulfat) in Erlenmeyerkolben zu 25 ml destilliertem Wasser und verfährt wie oben beschrieben. Jede Lösung wird zweimal gegen den Leerwert photometriert und die erhaltenen Werte auf Millimeterpapier aufgetragen. Durch die Punkte zeichnet man eine Eichgerade und liest dann aus der Extinktion der Analysenlösung die entsprechende Sulfatmenge ab. Diese wird auf 1 Liter hochgerechnet.
Versuchsergebnisse:
Für die Standardlösungen wurden gemessen:
Bei 1 mg Sulfat: E = 0,072 und 0.070
Bei 2 mg Sulfat: E = 0,142 und 0,140
Bei 4 mg Sulfat: E = 0,262 und 0,265
Bei 6 mg Sulfat: E = 0,390 und 0,395
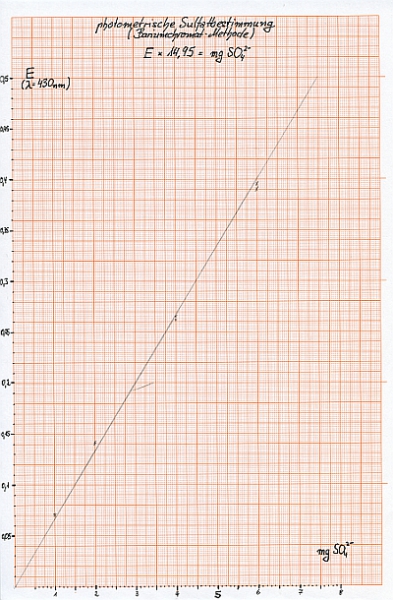
Regressionsgerade: E x 14,95 = mg SO42-
Leitungswasser: bei Einsatz von 25 ml Wasser wurde eine Extinktion von 0,140 und 0,140 gemessen, was 2,1 mg Sulfat entspricht. Das Wasser enthält also 84 mg/l Sulfat. Also war die visuell-nephelometrische Methode gar nicht so schlecht gewesen!
Mineralwasser „Schwarzwald-Sprudel“ (still): bei Einsatz von 25 ml wurde die Extinktion zu 0,272 und 0,275 erhalten. Das entspricht 4,1 mg Sulfat, also 164 mg/l.
Anhang: Darstellung von Bariumchromat
Man löst 4,88 g Bariumchlorid in 200 ml Wasser. Die Lösung muss ganz klar sein, anderenfalls wird filtriert. Daneben werden 2,94 g Kaliumdichromat in 50 ml Wasser gelöst. Die Dichromatlösung wird mit 20 ml 1 N Natronlauge (carbonatfrei) versetzt (Farbumschlag von orange nach gelb) und dann in die Bariumchloridlösung gegossen, worauf ein feiner, schwerer, zitronengelber Niederschlag ausfällt, der sich sehr rasch absetzt. Man dekantiert (etwa 4/5 des Volumens lassen sich problemlos abgießen) und schlämmt mindestens 6 x mit jeweils 100-150 ml heißem dest. Wasser auf und lässt wieder absitzen. Zuletzt gießt man in einen Erlenmeyerkolben um, lässt soweit wie möglich absitzen und gibt den Niederschlag auf ein analytisches Filter (für BaSO4, dicht, langsam filtrierend), weil er durch gewöhnliches Filtrierpapier hindurchläuft. Zuletzt wird zwischen Küchenkrepp abgepresst, der Niederschlag vom Filter abgehoben, in einer Abdampfschale zunächst auf der Heizung getrocknet, verrieben und schließlich für 2 Stunden auf 200°C erhitzt. Erhalten werden ca. 3,5 g eines feinen, schweren, blassgelben Pulvers (Ausbeute 70%)
Entsorgung:
Die chromathaltigen Lösungen werden zum anorganischen (Schwermetall-)Abfall gegeben.
Erklärungen:
Bariumchromat löst sich in verdünnten Säuren, indem sich das Dichromat bildet:
2 BaCrO4 + 2 H+ ---> BaCr2O7 + H2O + Ba2+
In der sauren Lösung kann das Barium nun mit Sulfat als unlösliches Bariumsulfat gefällt werden.
Ba2+ + SO42- ---> BaSO4
Danach macht man mit Ammoniak alkalisch, worauf das nicht umgesetzte Bariumdichromat wieder als Chromat ausfällt.
BaCr2O7 + Ba2+ + 2 OH- ---> 2 BaCrO4 + H2O
Dabei bleibt eine dem ausgefällten Bariumsulfat äquivalente Menge Chromat in Lösung und wird anschließend photometrisch bestimmt. Das Bariumchromat muß frei von anderen Bariumsalzen sein, da sonst die Relation Sulfat/Chromat nicht gewahrt ist! Deswegen ist bei der Darstellung auf carbonatfreie Lauge zu achten, oder man fällt von vorneherein mit Kaliumchromat. Zusammengefaßt lautet die Reaktion:
BaCrO4 + SO42- ---> BaSO4 + CrO42-
Allerdings ist die Löslichkeit des Bariumsulfats bei den in Frage kommenden geringen Mengen nicht zu vernachlässigen. Auch durch Fremdsalze (z.B. Kochsalz oder kleine Mengen Erdalkalien) wird sie beeinflusst. Durch die Reagenzlösung 1, die Natriumchlorid und etwas Schwefelsäure enthält, wird die Analysenlösung von vorneherein an Bariumsulfat gesättigt und die Salzkonzentration soweit angehoben, dass ein geringer zusätzlicher Salzgehalt der Analysenlösung nicht mehr ins Gewicht fällt. Der Reagenzienleerwert wird unter Einsatz dieser Lösung bestimmt, die deshalb sehr sorgfältig hergestellt und stets exakt abgemessen werden muss (Kolbenhubpipette!). Konzentration und Menge der zugesetzten Bariumchromatlösung (Reagenzlösung 2) sind dagegen weniger kritisch, da in jedem Fall ein Überschuss vorliegt, der seinerseits nicht bekannt zu sein braucht, weil er wieder ausgefällt wird.
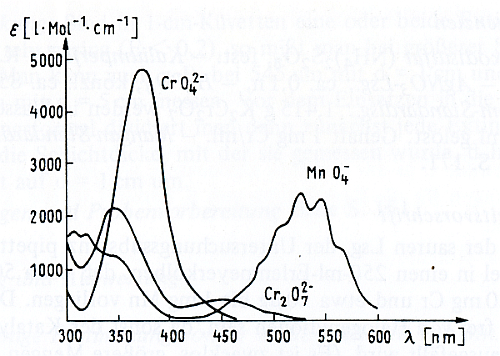
Absorptionsspektrum von CrO42-, Cr2O7 2-, und MnO42- (aus G. Wünsch – s. Literatur)
Das Absorptionsspektrum von Chromat zeigt ein Maximum bei 370 nm. Bei dieser Wellenlänge zu photometrieren ist aber aus zwei Gründen nicht ratsam. Erstens absorbieren auch Eisen(III)-Verbindungen - die in Wässern häufig enzutreffen sind - bei dieser Wellenlänge stark, und zweitens ist die Absorption des Chromates so hoch, dass ein Nullabgleich des Leeransatzes kaum möglich ist.
Störungen der Methode kommen vor, wenn das Wasser durch Dichromat oxidierbare organische Substanzen gelöst enthält. Diese müssen vor der Analyse durch tropfenweise Zugabe von 0,1 N Kaliumpermanganatlösung zur leicht angesäuerten Lösung in der Siedehitze oxidiert werden. Ionen, die mit Barium oder Chromat Niederschläge geben (Phosphat, Fluorid, Silber, Blei) stören ebenfalls. Phosphat kann zuvor als Magnesiumammoniumphosphat abgetrennt, störende Kationen können durch Ionenaustausch beseitigt werden.
Literatur:
Wünsch, Gerold: Optische Analysenmethoden zur Bestimmung anorganischer Stoffe, Walter de Gruyter Berlin New York 1976 (Sammlung Göschen Bd. 2606), ISBN 3-11-003908-7
Bilder:

Fällung von Bariumchromat

Bei 200°C getrocknetes Bariumchromat

Ansetzen der Reagenzlösungen

Kochen des zu untersuchenden Wassers mit den Reagenzien


Ein in den Messkolben überführter Ansatz vor (links) und nach (rechts) Zugabe von Ammoniak

Eichlösungen nach dem Zentrifugieren. Der Farbunterschied ist visuell kaum zu erkennen.

Photometrie