In Spirituosen, die außer Ethanol und Wasser nur unbedeutende Mengen an Begleitstoffen (Aromastoffe) enthalten und wasserhell sind, kann der Alkoholgehalt hinreichend genau durch einfache Bestimmung mit einem Aräometer erfolgen. Für Wein, Bier, Liköre und andere Getränke ist diese Methode nicht gangbar, da die Begleitstoffe die Dichte beeinflussen. Hier ist zuvor die Abtrennung des Ethanols durch Destillation erforderlich. Die im Folgenden beschriebene Methode ist an die Vorschrift der europäischen Pharmakopöe angelehnt. Zum qualitativen Nachweis des Ethanols im Destillat ist die Iodoformreaktion am besten geeignet und - wie hier gezeigt wird - erstaunlich empfindlich.
Material/Geräte:
Rundkolben 100 und 250 ml, Destillierbrücke mit Tropfenfänger nach Arzneibuch, Kugelkühler, Erlenmeyerkolben 50 und 100 ml, Becherglas 300 ml, Messzylinder 25 und 50 ml, Messzylinder 50 ml, Pyknometer 10 ml, Thermometer, Analysenwaage
Stativmaterial, Brenner, Reagenzgläser, Messzylinder 5 ml, Tropfpipette
Chemikalien:
Lugol’sche Lösung nach Ph.Eur. (2 g Iod + 4 g Kaliumiodid in 100 ml Wasser)


Natronlauge 1 N

Versuchsdurchführung:
Bestimmung des Ethanolgehaltes:
Man baut eine Destillationsapparatur auf, die aus folgenden Teilen besteht:
- einem Destillierkolben von 100-250 ml Inhalt der einige Siedeperlen enthält
- einer ansteigenden Destillierbrücke, die mit einem Tropfenfänger beginnt und in einem Schliffkonus endet
- einem Kugelkühler, der mit einer Schliffhülse senkrecht unter der Destillierbrücke angeschlossen wird und unten in einem geraden Rohr endet
Unter den Kühler stellt man einen Erlenmeyerkolben von 50-100 ml (je nach Menge des aufzufangenden Destillates, siehe weiter unten), der seinerseits in ein großes Becherglas mit kaltem Wasser gestellt wird.
Der Rundkolben wird mit dem Destillationsgut und Kochsalz beschickt, dabei werden auf 100 ml Flüssigkeit 25-30 g Salz zugegeben, dann wird zügig destilliert. Je nach Ethanolgehalt des Untersuchungsgutes werden folgende Mengen eingesetzt:
- bei einem Ethanolgehalt von mehr als 10 % wird das Analysengut so mit Wasser zu 50 ml verdünnt, dass ein Ethanolgehalt von 5-10% resultiert (z.B. 20 ml + 30 ml Wasser) und 10-15 g Salz zugefügt.
- bei einem Gehalt von unter 10 % Ethanol werden 50 ml des Untersuchungsgutes (bei weniger als 5% 100 ml) unverdünnt unter Zusatz von 20-30 Gewichts% Salz destilliert
Es werden 20-24 ml aufgefangen, was etwa 15 Minuten benötigt. Das Destillat wird auf 20 °C temperiert (mit Thermometer kontrollieren!) und im Messkolben mit Wasser auf 25,0 ml verdünnt (Vorlage nachspülen). Die Dichte dieser Verdünnung wird wie unten angegeben bestimmt. Um zu verhindern, dass versehentlich mehr als 25 ml aufgefangen werden, bringt man auf der Vorlage eine Markierung an. Sollte doch mehr überdestilliert sein, so bestimmt man das Volumen des Destillates in einem Messzylinder.
Die Dichte ermittelt man mit Hilfe eines Pyknometers. Dabei muss genau auf die Temperatur geachtet werden (Raumtemperatur!). Das Gerät wird zunächst leer auf der analytischen Waage austariert. Dann füllt man es mit destilliertem Wasser von 20°C und ermittelt das Gewicht des Wassers. Das Volumen des Pyknometers errechnet sich nach:
V = mWasser : (0,9982-0.0012) = mWasser : 0,997
Darin ist 0,9982 die Dichte des Wassers bei 20 °C und 0,0012 der Luftauftrieb.
Nun leert man das Pyknometer möglichst vollständig, spült es mit einem Milliliter des zu bestimmendes Destillates aus, füllt es dann mit dem Destillat und wiegt erneut. Die Dichte (ρ20°C) errechnet sich, indem man das Gewicht der Flüssigkeit durch das Volumen des Pyknometers teilt. (Für sehr genaue Bestimmungen muss zusätzlich der Luftauftrieb (0,0012 abgezogen werden, was im Arzneibuch nicht vorgesehen ist). Aus der Dichte ergibt sich unter Zuhilfenahme einer Tabelle (Anhang zum Arzneibuch) direkt der Alkoholgehalt des Destillats. Dieser wird dann auf die Ausgangsmenge des Analysengutes umgerechnet
Versuchsergebnisse:
Das von mir verwendete 10 ml-Pyknometer fasst bei 20 °C 10,532 g Wasser, hat also einen Rauminhalt von 10,564 ml.
1. 20 ml Kirschlikör (aus Eigenansatz) wurden mit 30 ml Wasser verdünnt und unter Zugabe von 15 g Salz etwas mehr als 20 ml abdestilliert. Das Destillat wurde zu 25,0 ml ergänzt und im Pyknometer ausgewogen. Das Gewicht von 10,309 g ergibt eine Dichte von 0,9759, was einem Ethanolgehalt von 17,6 Volumenprozent entspricht. Der Likör enthält daher (17,6 x 25/20 ) 22,3 Vol-% Alkohol.
2. 80 ml Holundersekt wurden unter Zusatz von 25 g Salz destilliert (Sekt u.a. kohlendioxidhaltige Getränke müssen zuvor einen Tag offen stehen gelassen und filtriert werden, damit die Kohlensäure größtenteils entweicht). Es wurden knapp 25 ml Destillat aufgefangen und zu 25,0 ml ergänzt. Im Pyknometer gewogen, fand ich 10,22 g, Das ergibt eine Dichte von 0,9674, mithin 25,6 Volumenprozent Ethanol im Destillat, was auf 100 ml Ausgangssubstanz hochgerechnet einem Alkoholgehalt von 8 % entspricht.
3. Von dem untersuchten Holundersekt wurden 37 ml mit Wasser auf 100 ml verdünnt (Gesamtmenge an Ethanol: 2,96 ml), mit 30 g Salz versetzt und etwas über 20 ml abdestilliert. Das Destillat wurde auf 25,0 ml aufgefüllt und die Dichte bestimmt. Sie lag bei 0,9823 (12 Volumenprozent Ethanol), was einer Alkoholmenge von 3 ml im Destillat entspricht. Die Ausbeute betrug bei diesem Vorgehen also 101 %.
Ethanolnachweis mit der Iodoformprobe:
Um den Ethanol in dem erhaltenen Destillat qualitativ nachzuweisen, gibt man 5 ml davon in ein Reagenzglas und versetzt zuerst (!) mit 1 ml Natronlauge 1 N und gibt danach 15 Tropfen Lugol‘sche Lösung zu. Man lässt, ohne zu erwärmen (!), für 5-20 Minuten stehen. Bei Anwesenheit von Ethanol bildet sich eine gelbweiße Trübung von Iodoform, das sich als feiner Niederschlag am Boden des Reagenzglases absetzt.
Die Reaktion kann in Gegenwart von Aceton, Acetaldehyd, oder flüchtigen Karbonsäuren (z.B. Essigsäure) falsch positiv ausfallen. Die Störung durch Säuren kann beseitigt werden, indem man das Analysengut vor der Destillation mit Natronlauge leicht alkalisch macht.
Versuchsergebnisse:
1. Die Probelösung muss zuerst mit NaOH alkalisch gemacht werden, bevor man die Iodlösung zugibt. Verfährt man umgekehrt, so bleibt die Iodoformbildung aus.
2. Die Reaktionsmischung darf nicht erwärmt werden, da sich sonst kein Iodoformniederschlag bildet. Gebildete Niederschläge lösen sich beim Erwärmen auf.
3. Die verwendete Lugol’sche Lösung wird am besten frisch angesetzt, da der Gehalt während der Aufbewahrung abnimmt. Bei zu niedriger Iodkonzentration der Lösung ist der Reaktionsausfall unsicher.
Die Iodoformprobe in der angegebenen Form ist erstaunlich empfindlich. Mit einer Lösung von 1 % Ethanol in Wasser erhält man nach 15 Minuten noch eine deutlich positive Reaktion.
Entsorgung:
Die Reste werden mit dem Abwasser entsorgt.
Erklärungen:
Die Gehaltsbestimmung über die Dichte des Destillats einer ethanolhaltigen Flüssigkeit ist eine seit über 100 Jahren etablierte Methode. Das hier beschriebene Vorgehen weicht von der Arzneibuchvorschrift dadurch ab, dass Kochsalz zugefügt wird. Dadurch kann die Menge des Destillats verringert und das Verfahren beschleunigt werden. Außerdem verhindert das Salz ein allzu starkes Schäumen der Flüssigkeit. In der Pharmazie enthalten die zu untersuchenden Lösungen gelegentlich signifikante Mengen anderer wasserdampfflüchtiger Stoffe (Essigsäure, ätherische Öle), welche die Dichte des Destillats verfälschen können und vorher aus der Analysensubstanz abgetrennt (etherische Öle werden ausgesalzen und mit Petrolether ausgeschüttelt) oder neutralisiert werden (flüchtige Säuren). Die Destillation kann natürlich prinzipiell auch an einem normalen, absteigenden Kühler vorgenommen werden. Die hier verwendete ansteigende Destillierbrücke mit Tropfenfänger hat den Vorteil, dass eine Verunreinigung des Destillats beim Stoßen oder Schäumen des Kolbeninhalts weitgehend verhindert wird.
Die verschiedenen Definitionen der Dichte führen leicht zu Verwirrung. Die absolute Dichte wird als Quotient von Masse und Volumen nach dem SI-System in der Einheit kg/m-3 angegeben und mit dem griechischen Buchstaben ρ (rho) bezeichnet. Da sie stark temperaturabhängig ist, wird die Messtemperatur als Index angegeben, so bezeichnet ρ20 die Dichte bei 20 °C. Unter relativer Dichte, die mit dem lateinischen Buchstaben d bezeichnet wird, versteht man den Quotienten zwischen der Masse der Substanz und der Masse eines gleichen Volumens Wasser. Relative Dichten werden mit dem Pyknometer bestimmt, wobei der Rauminhalt nicht genau bekannt zu sein braucht. In der Regel wiegt man sowohl die Substanz als auch das Wasser bei 20 °C und gibt die Dichte als d2020 an. Das Wasser kann aber auch bei 4 °C gewogen werden, die relative Dichte wird dann als d420 bezeichnet.
Die Beziehung zwischen (absoluter) Dichte ρ20 und relativer Dichte d2020, ist durch die Dichte des Wassers bei 20 °C gegeben:
ρ20 = 0,9982 x d2020
Die detaillierten Ethanoltabellen der Arzneibücher – bis auf die 4.oder 5. Stelle hinter dem Komma – beziehen sich auf die absolute Dichte. Wird diese mit einem Pyknometer bestimmt, so ist bei der Volumenbestimmung wie oben beschrieben der Luftauftrieb (0,0012) in Rechnung zu stellen. Ganz exakt wird die absolute Dichte folgendermaßen berechnet:
ρ20 = mS / m Wasser x (0,9982-0,0012) + 0,0012
Worin mS die Masse der Substanz ist, (0,9982-0,0012) die Dichte des Wassers, vermindert um die mittlere Luftdichte und +0,0012 ebenfalls die Dichte der Luft, da das Pyknometer in ihr einen Auftrieb erfährt. Durch Vernachlässigen der letzteren Korrektur in der Pharmakopöe werden die Dichtewerte in der 3. Dezimalstelle um eine Einheit zu niedrig gefunden, was in dem hier interessierenden Bereich immerhin eine Schwankung des Ethanolgehaltes um 1 % (absolut) ausmacht. Beispiel:
Dichte unkorrigiert = 0,9759 entspricht 17,8 Vol% Ethanol
Dichte korrigiert = 0,9771 entspricht 16,7 Vol% Ethanol
Die Iodoformbildung verläuft folgendermaßen:
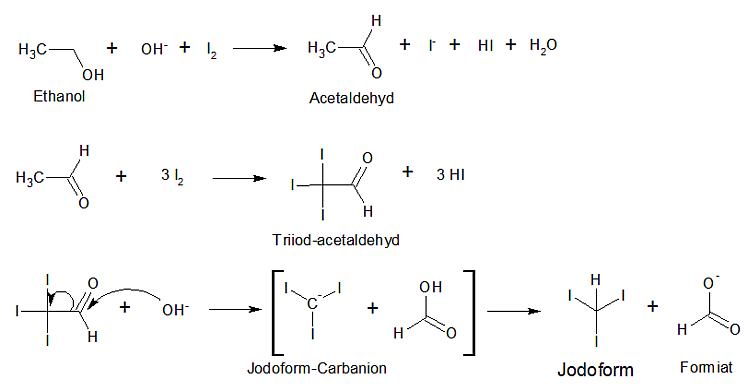
Das ausgeschiedene Iodoform ist besonders gut zu erkennen, wenn man den Niederschlag absitzen lässt und gegen einen dunklen Untergrund beobachtet. Es besitzt einen charakteristischen Geruch („nach Zahnarzt“) und wurde als Lokalantiseptikum verwendet. Der Geruch ist dermaßen anhaftend, dass zu früheren Zeiten in den Apotheken spezielle Waagen, Reibschalen, Löffel und Pillenbretter bereitstanden, die mit der Aufschrift „Jodoform“ gekennzeichnet waren, und in denen die Substanz ausschließlich verarbeitet werden durfte.
Literatur:
Bamann E, Ullmann E: Chemische Untersuchung von Arzneigemischen, Arzneispezialitäten und Giftstoffen; Wissenschaftliche Verlagsgesellschaft Stuttgart 1960
Deutsches Arzneibuch, 7.Ausgabe 1968; Wissenschaftliche Verlagsgesellschaft Stuttgart 1968
Hartke – Mutschler (Hrsg.): DAB 9 Kommentar; Wissenschaftliche Verlagsgesellschaft Stuttgart 1987, Bd 1. ISBN 3-8047-0904-4
Küster-Thiel: Rechentafeln für die chemische Analytik 102. Auflage; Walter de Gruyter - Berlin, New York 1982; ISBN 3-11-006653-X
Bilder:

Das Analysengut

Destilliervorrichtung mit Destillationsbrücke und Tropfenfänger

Der Tropfenfänger im Detail

Auswiegen des gefüllten Pyknometers

positive Iodoformprobe

Empfindlichkeit der Iodoformreaktion
Die Verdünnungsreihe enthält 20, 10, 5, 2,5 und 1% Ethanol in der Ausgangsprobe, ganz rechts der Leerwert

Iodoformwaage