Die Cerimetrie ist eine maßanalytische Methode, bei die Oxidationswirkung von Cer(IV)-salzen ausgenutzt wird. Ihre Anwendungsmöglichkeiten sind vielfältig und decken sich weitgehend mit denen der Permanganatometrie. Gegenüber dem Kaliumpermanganat haben die Cer(IV)-lösungen aber mehrere Vorteile. Im Folgenden wird die Einstellung der Maßlösung beschrieben. Als Anwendungsbeispiele werden die Gehaltsbestimmung von Wasserstoffperoxid, Natriumnitrit und des Arzneimittels Paracetamol geschildert.
Geräte:
Erlenmeyerkolben 300 ml, Becherglas 250 ml, diverse Messzylinder, Messpipetten 20 ml und 10 ml, Kolbenhubpipette 1000 µl, Messkolben 100 ml, Waage, Bürette, 100 ml-Rundkolben mit Rückflusskuhler, Brenner, Dreifuß und Drahtnetz, Trichter, Magnetrührer (optional)
Chemikalien:
Ammoniumcer(IV)-nitrat


Schwefelsäure (konzentrierte und 25 %)

Salzsäure 2 N


Salpetersäure p.A. 65 %


Arsen(III)-oxid p.a.




Natronlauge 1 N

Osmium(VIII)-oxidlösung 0,25 %


Ferroin-Lösung 0,01 M
Natriumthiosulfatlösung 0,1 N
Kaliumiodid

Stärkelösung 1%
Analysengut:
Natriumnitrit



Wasserstoffperoxidlösung 30%


käufliche Paracetamol-Tabletten
Sicherheitshinweise:
Vorsicht beim Arbeiten mit Arsen(III)-oxid, das nicht nur stark giftig, sondern auch carcinogen ist!
Versuchsdurchführung:
1. Herstellung der 0,1 N Ammoniumcer(IV)-nitratösung und Titerbestimmung:
In einem 100 ml-Becherglas verrührt man 13,7 g Ammoniumcer(IV)-nitrat (Ce(NH4)2(NO3)6 ) mit 13 ml konzentrierter Schwefelsäure. Nach 2 Minuten wird die Mischung in ca. 100 ml Wasser gegeben und das Becherglas nachgespült. Nachdem die Flüssigkeit abgekühlt ist, wird mit Wasser auf 250 ml aufgefüllt, über Nacht stehen gelassen (am besten in einem hohen Becherglas oder Messzylinder) und von einem eventuell ausgefallenen Bodensatz abgegossen. Die so erhaltene Lösung ist etwa 1-molar an Schwefelsäure.
Zur Einstellung löst man 100,0 mg trockenes, analysenreines Arsen(III)-oxid (Urtitersubstanz) unter leichtem Erwärmen in einer Mischung aus 1 ml 1 N Natronlauge und 10 ml Wasser, gibt 25 ml Schwefelsäure 25 % zu und füllt mit Wasser auf ca. 80 ml auf. Nach Zugabe von 3-4 Tropfen Osmium(VIII)-oxidlösung und 2 Tropfen Ferroinlösung erhält man eine orangerote Flüssigkeit. Man titriert mit der einzustellenden Ammoniumcer(IV)-nitratlösung, bis die rote Farbe verschwindet. Der Umschlag ist sehr scharf. Die Lösung ist danach kaum wahrnehmbar blassblau gefärbt.
Ein Milliliter Cer(IV)-lösung entspricht 4,946 mg Arsen(III)-oxid, 100 mg des Urtiters benötigen zur Oxidation somit 20,218 ml. Bei meinem Versuch wurden 20,55 ml Maßlösung verbraucht, was einen Faktor von 20,218 ml : 20,55 ml = 0,984 ergibt.
Anmerkung:
Man kann auch vom Ammoniumcer(IV)-sulfat (Ce(NH4)4(SO4)4 x 2 H2O) ausgehen. Von diesem werden 16,25 g in 250 ml 1 M Schwefelsäure gelöst und die Lösung dann eingestellt. Als Urtiter ist auch Natriumoxalat oder Oxalsäure (in salzsaurer Lösung mit Iodmonochlorid als Katalysator) geeignet.
2. Cerimetrische Bestimmungen:
2.1 Bestimmung von Wasserstoffperoxid:
Für die Analyse muss das Wasserstoffperoxid auf eine Konzentration von ca. 0,3 % verdünnt werden. Dazu werden von 30 %igem Wasserstoffperoxid 1000 µl (bei niedrigerer Konzentration entsprechend mehr) mit der Kolbenhubpipette in den Messkolben gegeben und mit Wasser auf 100,0 ml aufgefüllt. Von der Verdünnung werden 10 ml mit einer Vollpipette in ein Becherglas überführt, 25 ml Schwefelsäure 25 % und 2 Tropfen Ferroinlösung zugegeben und mit Wasser auf ca. 80 ml verdünnt. Dann titriert man unter ständigem Rühren mit der 0,1 N Ammoniumcer(IV)-nitratlösung, bis die orangeröte Farbe verschwindet. Während der Titration macht sich die Entstehung von Sauerstoff in Form von Gasbläschen bemerkbar. Die Farbe des Indikators blasst etwas ab, weshalb es von Vorteil sein kann, anfangs nur einen und kurz vor Ende der Titration einen weiteren Tropfen Ferroinlösung zuzusetzen. Ein Milliliter Cer(IV)-lösung entspricht 1,701 mg Wasserstoffperoxid.
Bei meinem Versuch wurden 20,375 ml Titerlösung verbraucht, das sind 20,375 x 0,984 x 1,701 = 34,1 mg Wasserstoffperoxid. Berücksichtigt man die Dichte (1,115 g/ml), so beträgt der Gehalt 30,6 Gewichtsprozent, was den Anforderungen des Arzneibuches (Gehalt 29,0 - 31,0 Gewichtsprozent) entspricht.
2.2 Bestimmung von Nitrit:
Das zur Analyse vorliegende Natriumnitrit wird zunächst gut verrieben, dann in dünner Schicht für 2 Stunden bei 110 °C getrocknet und zuletzt im Exsikkator abkühlen gelassen. Davon löst man 300,0 mg im Messkolben zu 100,0 ml.
In einem Becherglas legt man 20,0 ml Ammoniumcer(IV)-nitratlösung vor, verdünnt mit 80 ml Wasser und gibt 10 ml Salpetersäure 65 % zu (die Salpetersäure muss analysenrein sein und darf keine freien Stickstoffoxide enthalten!). Das Becherglas wird dann auf dem Magnetheizrührer in einem Wasserbad auf ca. 60 °C erwärmt. Wenn die Arbeitstemperatur erreicht ist, titriert man mit der Natriumnitritlösung, bis die gelbe Farbe des Cer(IV) fast ganz verblasst ist. Nun werden 2 Tropfen Ferroinlösung zugegeben, worauf die Farbe nach Blaugrün wechselt. Man titriert tropfenweise, aber zügig, weiter, bis die Farbe des Indikators über Blassblau scharf nach Blassrosa umschlägt.
Ein Milliliter 0,1 N Cer(IV)-lösung entspricht 3,45 mg Natriumnitrit. Die vorgelegten 20 ml sind daher 20 x 0,984 x 3,45 = 67,9 mg Natriumnitrit äquivalent. Bis zum Umschlag wurden 22,75 ml Natriumnitritlösung verbraucht, welche 22,75 x 300/100 = 68,3 mg meiner Ausgangssubstanz entsprechen. Der Gehalt beträgt 99,3 %.
Alternativ kann unter Vermeidung des Erwärmens so vorgegangen werden: In einem 100 ml-Erlenmeyerkolben werden 20,0 oder 25,0 ml 0,1 N Ammoniumcer(IV)-nitratlösung mit 10 ml Salpetersäure 25% gemischt und auf den Magnetrührer gestellt. Sodann pipettiert man unter leichtem Rühren 10,0 ml der Nitritlösung so ein, dass die Pipettenspitze in die Flüssigkeit eintaucht, verschließt den Kolben und lässt 2-3 Minuten stehen. Dann gibt man 1 g Kaliumiodid hinzu und titriert das ausgeschiedene Iod mit 0,1 N Natriumthiosulfatlösung zurück, wobei gegen Ende 1 ml Stärkelösung zugegeben wird. Der Faktor der Natriumthiosulfatlösung muss zuvor durch Titration von 10,0 ml Ammoniumcer(IV)-nitratlösung, 5 ml Salpetersäure, 20 ml Wasser und 1 g Kaliumiodid frisch bestimmt werden. Bei meinem Versuch war das Ergebnis identisch zu der in der Wärme vorgenommenen Titration.
2.3 Bestimmung von Paracetamol:
Eine Tablette Paracetamol (deklarierter Gehalt 500 mg) wird in einem 100 ml-Rundkolben mit 25 ml Wasser und 15 ml Schwefelsäure 25% übergossen und nach Aufsetzen eines Rückflußkühlers für 1 Stunde erhitzt, so dass die Mischung ständig leicht siedet. Nach Ablauf der Zeit kühlt man durch Eintauchen des Kolbens in kaltes Wasser ab, spült den Kühler mit etwas Wasser aus und überführt den Kolbeninhalt dann unter Nachspülen in einen 100 ml-Messkolben. Dann wird mit Wasser bis zur Marke aufgefüllt, gut umgeschüttelt und verschlossen stehen gelassen, bis sich die unlöslichen Hilfsstoffe (Titandioxid, Simeticon, Stearinsäure,…) weitgehend abgesetzt haben, was etwa 3 Stunden dauert. Von der überstehenden, klaren, gelb gefärbten Flüssigkeit werden 20,0 ml (1/5 der Ausgangsmenge) mit einer Vollpipette entnommen und in einem Becherglas mit 15 ml 2 N Salzsäure, 40 ml Wasser und 40 g zerstoßenem Eis gemischt und mit 2 Tropfen Ferroinlösung versetzt. Dann titriert man möglichst rasch mit 0,1 N Cer(IV)-lösung. Anfangs tritt eine Farbvertiefung von orangegelb zu rötlich ein, die sich am Äquivalenzpunkt aufhellt und dann scharf in Hellgelb umschlägt. Ein Milliliter Cer(IV)-Lösung entspricht 7,56 mg Paracetamol.
Bei meinem Versuch wurden 13,5 ml Maßlösung verbraucht . Diese entsprechen 13,5 x 0,984 x 7,56 = 100,4 mg Paracetamol. Die Tablette enthielt also 502 mg, was innerhalb der erlaubten Schwankungsbreite liegt.
Anmerkungen:
- Um die erforderliche Menge Eis parat zu haben, gibt man vor dem Versuch 40 ml Wasser in einen kleinen, sauberen Plastikbeutel (Zipverschlussbeutel, Gefrierbeutel), stellt diesen in ein Becherglas und lässt im Tiefkühlfach gefrieren. Das Eis kann mit einem Hammer im Beutel zerkleinert werden und wird dann einfach aus dem Beutel in das Titriergefäß gegeben.
- Ich habe den Versuch auch bei Zimmertemperatur ausgeführt, unter Zusatz von 40 ml Wasser anstelle des Eises. Dabei färbt sich die Untersuchungslösung bei der Zugabe des Ammoniumcer(IV)-nitrates tiefviolett. Der Umschlag war dennoch gut zu erkennen und die Lösung am Äquivalenzpunkt orangegelb gefärbt. Man muss aber rasch titrieren, da die violettrote Farbe bald wiederkehrt.
Ein Mittelweg kann dermaßen beschritten werden, dass man vor der Titration (während man die Untersuchungslösung sich klären lässt) ein Becherglas mit 40 ml Wasser und 15 ml 2 N Salzsäure in den Kühlschrank stellt. Nach Zugabe von 20 ml Untersuchungslösung und Ferroin wird titriert, wobei sich die Farbe nur wenig vertieft. Das Ergebnis war bei mir bei allen drei Titrationen identisch (13,5 ml Maßlösung). Bei einer sehr langsamen Titration wurde unter Verwendung von Eis ein zu hoher Gehalt gefunden (Verbrauch 13,9 ml entsprechend. 103,4 mg Paracetamol).
Entsorgung:
Die austitrierten Flüssigkeiten werden zu den Schwermetallabfällen gegeben.
Erklärungen:
Die der Cerimetrie zugrundliegende Redoxreaktion lautet:
Ce4+ + e- <---> Ce3+
Das Normalpotential dieser Reaktion beträgt +1,28 V. In 1 M Schwefelsäure liegt es bei +1,44 V und damit nahe dem des Kaliumpermanganates (+1,51 V). Cerimetrisch lassen sich daher fast alle maßanalytischen Bestimmungen, zu denen Kaliumpermanganatlösung eingesetzt wird, ebenfalls durchführen. Unter anderem lassen sich Oxalsäure und Oxalate, Eisen(II), Nitrit, Antimon(III), Arsen(III) und Hexacyanidoferrat(II) cerimetrisch bestimmen. Im Gegensatz zu Permanganatlösungen sind Cer(IV)-Maßlösungen, die etwa 0,5-1 M Schwefelsäure enthalten, sehr stabil und die Redoxreaktionen mit Cer sind eindeutig, da nur zwei Oxidationsstufen möglich sind. Ausserdem ist die Maßlösung nicht so intensiv gefärbt wie die Kaliumpermanganatlösung (was das Ablesen des Meniskus erleichtert) und es kann auch in salzsaurem Medium gearbeitet werden (was mit Permanganat schlecht geht, da dieses Chlorid zu Chlor oxidiert und dadurch falsche Ergfebnisse erhalten werden können).
Um den Äquivalenzpunkt der Titration anzuzeigen verwendet man den Redoxindikator Ferroin (tris(1,10-Phenanthrolin)-eisen(II)-sulfat). Ferroin besitzt in 1 M Schwefelsäure ein Redoxpotential von +1,06 V. Seine reduzierte Form ist tiefrot, die oxidierte blassblau gefärbt. Auf 100 ml Flüssigkeit genügen 1 bis 2 Tropfen einer 0,1 M-Lösung. Gelegentlich wird eine 1 %ige Lösung von Diphenylamin in konz. Schwefelsäure als Redoxindikator verwendet (Redoxpotential +0,76 V).
Mit Cer(IV)-Lösungen wird stets in stark saurer Lösung (1-2 N) gearbeitet, um das Ausfallen basischer Cersalze zu verhindern. Die Titerstellung gegen Arsen(III)-oxid als Urtiter folgt der Gleichung:
4 Ce4+ + As2O3 + 5 H2O ---> 4 Ce3+ + 2 AsO43- + 10 H+
Molmasse Arsen(III)-oxid : 197,84 g/mol
Äquivalentmasse Arsen(III)-oxid: 49,46 g/val
Diese Reaktion verläuft aber nur in Gegenwart eines Katalysators glatt. Das Arzneibuch schreibt die Zugabe von Osmium(VIII)-oxid zur Titration in schwefelsaurer Lösung vor. Stattdessen kann auch eine Lösung von Iodmonochlorid (5 ml 0,005 M auf 100 ml Flüssigkeit) verwendet werden, die leicht aus Iodid und Iodat in Salzsäure selbst hergestellt werden kann. Dann muss jedoch in salzsaurem Medium (20 ml konzentrierte Salzsäure /100 ml) titriert werden.
Wasserstoffperoxid wird durch Cer(IV) wie durch Permanganat zu Sauerstoff oxidiert:
2 Ce4+ + H2O2 ---> 2 Ce3+ + O2 + 2 H+
Molmasse Wasserstoffperoxid: 34,02 g/mol
Da pro mol Wasserstoffperoxid 2 Elektronen abgegeben werden ist die Äquivalentmasse 17,01 g und 1 ml 0,1 N Maßlösung entsprechen 0,1 mval, somit 1,701 mg.
Die Bestimmung von Nitrit durch direktte Titration ist ungewöhnlich, indem die Maßlösung vorgelegt und mit der Analysenlösung titriert wird. Da in stark saurer Lösung und bei erhöhter Temperatur gearbeitet werden muss, würde sich das Nitrit zersetzen, wenn man dieses vorlegte. Der Indikator wird erst ganz zum Schluss zugegeben, weil er in der Wärme durch die anwesenden Oxidationsmittel bald zerstört wird. Die alternative Methode der Rücktitration ist bequemer, erfordert aber eine zweite Maßlösung. Die cerimetrische Bestimmung von Nitrit ist genauer als das permanganometrische Verfahren.
Nitrit wird durch Cer(IV) quantitativ zu Nitrat oxidiert:
NO2- + 2 Ce4+ + H2O ---> NO3- + 2 Ce3+ + 2 H+
Molmasse Natriumnitrit: 69,00 g/mol
Auch hier beträgt die Äquivalentmasse ½ der Molmasse und 1 ml 0,1 N Cer(IV)-Lösung entsprechen 0,1 mval = 3,45 mg Natriumnitrit oder 2,3 mg Nitrit.
Die Oxidationswirkung des Cers kann auch für die Bestimmung mancher organischer Verbindungen ausgenutzt werden. Insbesondere p-Aminophenol und Hydrochinonderivate lassen sich quantitativ zu Chinonimin bzw. Chinonen oxidieren. Die im Arzneibuch vorgeschriebene Bestimmung des bekannten Schmerzmittels Paracetamol (N-Acetyl-p-aminophenol) bedient sich dieser Vorgehensweise. Zunächst wird die Acetylgruppe durch säurekatalysierte Hydrolyse abgespalten und das gebildete p-Aminophenol anschließend durch Cer(IV) oxidiert:
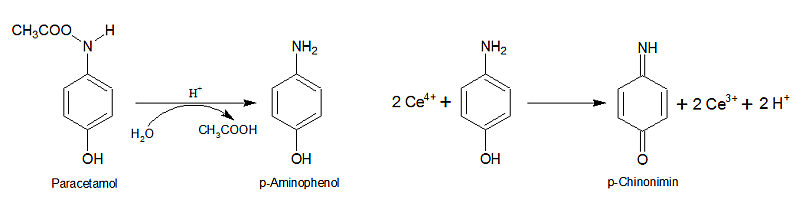
Molmasse Paracetamol: 151,2 g/mol
Äquivalentmasse Paracetamol: 75,6 g/val
Im Arzneibuch wird für diese Analyse Ammoniumcer(IV)-sulfatlösung vorgeschrieben. Die Ammoniumcer(IV)-nitratlösung ist nach den hier beschriebenen Versuchen aber offenbar genauso gut geeignet. Auch α-Tocopherol (Vitamin A) und Menadion (Vitamin K3) lassen sich durch Titration mit Cer(IV)-lösung quantitativ bestimmen.
Literatur:
Europäisches Arzneibuch, 7. Ausgabe
Jander/Jahr: Maßanalyse;, 17. Auflage 2009; Walter de Gruyter GmbH & Co. KG Berlin; ISBN 978-3-11-019447-0
Poethke, Walter: Praktikum der Maßanalyse; 2. Auflage 1980, Verlag Harri Deutsch, Thun und Frankfurt/Main; ISBN 3-87144-535-5
Bilder:

Die Ausgangssubstanz: Ammoniumcer(IV)-nitrat

Herstellen der Ammoniumcer(IV)-nitratlösung

Einstellung gegen Arsen(III)-oxid-Urtiter


Farbe der Lösung links zu Titrationsbeginn, rechts am Äquivalenzpunkt

Gehaltsbestimmung von Natriumnitrit in der Wärme




Farbwechsel der vorgelegten, salpetersauren Cer(IV)-Lösung bei der Titration mit Natriumnitrit in der Wärme. Oben vor dem Zusatz von Ferroin, unten nach Indikatorzugabe. Die blassblaue Farbe vor dem Titrationsendpunkt (linkes unteres Bild) ist hier leider nicht gut zu erkennen.

Erhitzen einer Paracetamoltablette in verdünnter Schwefelsäure unter Reflux

Entnahme von 20 ml der geklärten Analysenlösung aus dem Messkolben


Titration von Paracetamol mit Eis


Titration von Paracetamol bei Zimmertemperatur