Chromylchlorid ist eine ungewöhnliche Metallverbindung, denn sie ist unter Normalbedingungen flüssig und relativ flüchtig. Die Bildung von Chromylchlorid kann zur Identifizierung von Chlorid benutzt werden, wenn man sie mit einer empfindlichen Nachweisreaktion verknüpft.
Material/Geräte:
Reagenzgläser, schwerschmelzbares Reagenzglas, durchbohrter Gummistopfen mit Winkelrohr, Ampulle, Reibschale, Gasbrenner, Waage, Filtrierpapier, Pipette, 10 ml - Messzylinder
Chemikalien:
Kaliumdichromat



konzentrierte Schwefelsäure

Diphenylcarbazid

Essigsäure 99%

Ethanol 96%

Natriumchlorid
Chromylchlorid




Sicherheitshinweise:
Das entstehende Chromylchlorid, das teilweise in Dampfform entweicht, ist giftig und karzinogen. Obwohl die gebildeten Mengen sehr gering sind, sollte der Versuch unter einem Abzug durchgeführt werden.
Versuchsdurchführung:
1. Identifizierung von Chloriden durch Bildung von Chromylchlorid
Reagenzlösung: man mischt 20 mg Diphenylcarbazid mit 1 ml Essigsäure und füllt nach vollständiger Lösung mit Ethanol auf 10 ml auf. Das Reagenz ist nicht haltbar und muss täglich frisch hergestellt werden.
In ein trockenes Reagenzglas gibt man 200 mg gepulvertes Kaliumdichromat sowie eine Spatelspitze der zu prüfenden Substanz, die etwa 5-10 mg Chlorid entspricht. Man mischt durch Schütteln und übergießt mit 1 ml konzentrierter Schwefelsäure. Die Mündung des Reagenzglases deckt man mit einem Filtrierpapierstreifen ab, den man mit einigen Tropfen der Diphenylcarbazidlösung befeuchtet. Bei Anwesenheit von Chlorid in der Prüfsubstanz bilden sich im Reagenzglas braunrote Dämpfe und auf dem Reagenzpapier erscheint ein violettroter Fleck. Die Reaktion ist ziemlich empfindlich. 2 mg Kochsalz (ca. 1,2 mg Chlorid) geben nach 3-5 Minuten eine deutlich erkennbare Färbung. Die Reaktion lässt sich durch vorsichtiges (!) Erwärmen beschleunigen.
Mit Bromiden und Iodiden können braune bzw. violette Dämpfe entstehen, das Reagenzpapier färbt sich jedoch lediglich gelb oder bräunlich. Fluoride reagiert nicht. Organische Salze mit anionischem Chlorid reagieren eindeutig (z.B. Methylenblau). Mit Silberchlorid bleibt die Reaktion aber seltsamerweise negativ.
2. Präparative Darstellung von Chromylchlorid
Man verreibt 1 g Kaliumdichromat gründlich mit 0,7 g Natriumchlorid, gibt das Gemisch in ein trockenes schwer schmelzbares Reagenzglas und fügt 3 ml konzentrierter Schwefelsäure zu. Man verschließt sofort mit dem vorbereiteten Stopfen, in dessen Bohrung das gebogene Glasrohr steckt, welches an Ende des langen Schenkels zu einer Spitze ausgezogen ist. Das Reagenzglas wird solange leicht geschüttelt und leicht erwärmt, bis sich die Salzmischung gelöst hat. Dabei erkennt man, wie sich das gebildete Chromylchlorid als dunkelrotbraune Schicht auf der Schwefelsäure ansammelt. Wenn die Mischung nicht ganz homogen verrieben wurde oder zu viel Natriumchlorid enthält, entweicht initial Chlorwaserstoff unter Aufschäumen. Anschließend wird das Glasrohr mit der Spitze möglichst weit in eine vollkommen trockene (!) Ampulle eingeführt. Die Ampulle steht zur Kühlung in einem Becherglas mit eiskaltem Wasser. Man erhitzt nun stärker, wobei die braunen Dämpfe anfangs an den Wänden des Reagenzglases als ölige Tropfen herabrinnen. Das Chromylchlorid kondensiert im Glasrohr und tropft als klare, braunrote Flüssigkeit in die Ampulle. Wenn nichts mehr übergeht, tauscht man die Ampulle durch ein trockenes Reagenzglas aus und lässt die Apparatur abkühlen. Das Produkt wird in der Ampulle eingeschmolzen. Ausbeute: ca. 0,6 g (60 % d. Th.)
Entsorgung:
Der Rückstand in den Reagenzgläsern wird vorsichtig mit Wasser verdünnt, mit NaOH neutralisiert und zu den Schwermetallabfällen gegeben. Das Produkt wird durch Eintropfen in Wasser hydrolysiert, neutralisiert und ebenfalls als Schwermetallabfall entsorgt.
Erklärungen:
Das Chromylchlorid (systematische Bezeichnung: Chrom(VI)-oxiddichlorid) bildet sich aus dem in der Reaktionsmischung gebildeten Chlorwasserstoff und Chrom(VI)-oxid unter Wasserabspaltung. Die Schwefelsäure bindet das freiwerdende Wasser:
NaCl + H2SO4 ---> HCl + NaHSO4
K2Cr2O7 + 2 H2SO4 ---> 2 CrO3 + KHSO4 + H2O
2 HCl + CrO3 ---> CrO2Cl2 + H2O
Oder, zusammengefasst:
4 NaCl + 6 H2SO4 + K2Cr2O7 ---> 2 CrO2Cl2 + H2O + 6 Na/KHSO4
Molmasse Kaliumdichromat: 294,2 g/Mol
Molmasse Natriumchlorid: 58,5 g/Mol
Molmasse Chromylchlorid: 154,9 g/Mol
Chromylchlorid ähnelt vom Aussehen her stark dem Brom. Es handelt sich um eine schwere (Dichte 1,915 g/cm3!), braunrote, leicht bewegliche Flüssigkeit, die bei Zimmertemperatur bereits merklich unter Bildung brauner Dämpfe flüchtig ist. Ebenfalls ähnlich dem Brom absorbiert es im nahen Infrarot praktisch gar nicht, weshalb es, mit einer Nachtsichtkamera aufgenommen, vollkommen durchsichtig erscheint. Der Schmelzpunkt liegt bei -97 °C, der Siedepunkt bei 117 °C. Mit Wasser tritt rasch Hydrolyse ein, wobei Salzsäure und Chrom(VI)-oxid - bzw. mit viel Wasser gleich Chrom(VI)-säure - gebildet werden:
CrO2Cl2 + 2 H2O ---> 2 HCl + H2CrO4
Der Nachweis des gebildeten Chromylchlorids beruht darauf, dass die auf dem Reagenzpapier gebildete Chromsäure Diphenylcarbazid zu Diphenylcarbazon oxidiert und dabei zu Cr3+ reduziert wird.
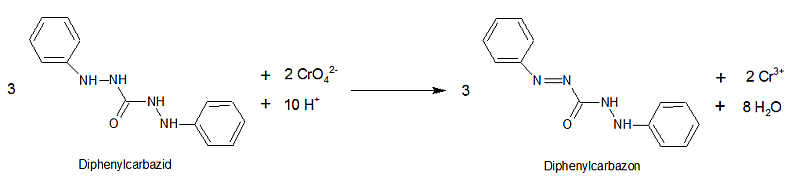
Diphenylcarbazon bildet mit Chrom(III)-Ionen einen tiefvioletten Komplex. Da die anderen Halogene unter diesen Versuchsbedingungen keine flüchtigen Chromverbindungen bilden, ist die Reaktion recht spezifisch. Sie wird als alternative Identifizierungsreaktion für Chloride (neben der Fällung von Silberchlorid aus salpetersaurer Lösung) im Europäischen Arzneibuch geführt. Dort wird zur Herstellung der essigsauren Diphenylcarbazidlösung wasserfreies Ethanol verlangt, aber wie hier gezeigt funktioniert der Versuch auch mit 96%igem Ethanol (vermutlich ist die Haltbarkeit der Reagenzlösung kürzer). Auffällig ist, dass der Nachweis nach meinen Versuchen mit Silberchlorid - auch beim Erwärmen - negativ verläuft.
Literatur:
Europäisches Arzneibuch 7. Ausgabe 2011
Jander G, Blasius E: Lehrbuch der analytischen und präparativen anorganischen Chemie; 11. Auflage 1979, S. Hirzel Verlag Stuttgart; ISBN 3-7776-0353-8
Bilder:

Chromylchloridreaktion mit 25 und 10 mg Natriumchlorid (links und Mitte), negative Reaktion mit 30 mg Natriumbromid (rechts)
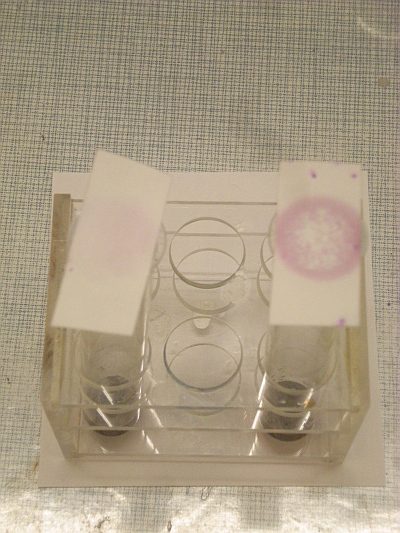
Chromylchloridreaktion mit 2 mg (links) und 5 mg (rechts) Natriumchlorid

Darstellung von Chromylchlorid (das hier abgebildete Kühlen des Glasrohres durch feuchtes Fließpapier sollte man unterlassen, damit keine Feuchtigkeit ins Produkt gelangt. Luftkühlung ist ausreichend).

Ampulle mit eingeschmolzenem Produkt. Offenbar ist Feuchtigkeit eingedrungen, denn es haben sich Kristalle von Chrom-VI-oxid an der Ampullenwandung abgeschieden

Ein zweites Präparat, das unter weitgehendem Ausschluss von Feuchtigkeit eingeschmolzen wurde. Am Ampullenhals bildet sich durch thermische Zersetzung beim Abschmelzen etwas grünes Chrom(III)-oxid

Das Chromylchlorid mit einer IR-Kamera aufgenommen
Videoaufnahme des Präparates bei Tageslicht und im IR:
link zum Video
<object width="420" height="315"><param name="movie" value="//www.youtube.com/v/MZK4955qMVo?version=3 ... ram><param name="allowFullScreen" value="true"></param><param name="allowscriptaccess" value="always"></param><embed src="//www.youtube.com/v/MZK4955qMVo?version=3&hl=de_DE" type="application/x-shockwave-flash" width="420" height="315" allowscriptaccess="always" allowfullscreen="true"></embed></object>
Danksagung:
Danke an Pok für die Bereitstellung der IR-Aufnahme und des Videos!