Die massanalytische Methode nach Volhard, wobei die zu bestimmende Substanz mit Silbernitratlösung im Überschuss versetzt und dann das überschüssige Silber mit Ammoniumthiocyanatlösung zurücktitriert wird, ist eine vielseitige Technik, die auch zur Bestimmung von Arzneimitteln angewandt wird. Voraussetzung ist, dass der Analyt mit Silber einen schwerlöslichen Niederschlag bildet. Hier wird die Gehaltsbestimmung von meso-2,3-Dimercaptobernsteinsäure (Succimer) geschildert.
Material/Geräte:
Analysenwaage, Messkolben 100 ml und 50 ml, Vollpipetten 20 und 25 ml, Messzylinder 25 ml, Erlenmeyerkolben mit Stopfen, Bechergläser, Bürette, Trichter und Filter, Magnetrührer (optional)
Chemikalien:
Silbernitratlösung 0,1 N

Ammoniumthiocyanat


Natriumchloridlösung 0,1 M
Ammoniumeisen(III)-sulfatlösung 10 %

Salpetersäure 25 %

Nitrobenzol


Ethanol 96%


Analysengut:
meso-2,3-Dimercaptobernsteinsäure

Versuchsdurchführung:
Herstellung und Einstellung der 0,1 N Ammoniumthiocyanatlösung
Ammoniumthiocyanat ist hygroskopisch und kann nicht ohne Zersetzung getrocknet werden, so dass man es nicht als Urtitersubstanz verwenden kann. Statt dessen löst man 2,0 g davon in 250 ml Wasser und stellt die Lösung gegen eine Silbernitratlösung von bekanntem Gehalt ein. Der Faktor der Silbernitratlösung muss zuvor nach Fajans ermittelt worden sein.
Man legt 20,0 ml der 0,1 N Silbernitratlösung vor, verdünnt mit Wasser auf ca. 50 ml und gibt 2,5 ml Salpetersäure 25 % sowie 3 ml Ammoniumeisen(III)-sulfatlösung zu. Dann wird mit der einzustellenden Ammoniumthiocyanatlösung titriert. In der Flüssigkeit fällt ein schneeweißer, flockiger Niederschlag aus, während sich an der Eintropfstelle dunkel-braunrote Schlieren bilden, die sich zunächst rasch wieder auflösen. Schließlich bewirkt ein einziger Tropfen der Thiocyanatlösung eine gleichmäßige rötliche Färbung der Flüssigkeit, die eventuell nur als Orangefärbung imponiert, während der Niederschlag rein weiß bleibt.
Bei meinem Versuch wurde eine Silbernitratlösung mit f = 0,995 eingesetzt. Verbraucht habe ich 19,2 ml Ammoniumthiocyanatlösung. Der Faktor dieser Lösung beträgt also 19,9 : 19,2 = 1,036.
Bestimmung von Chlorid nach Volhard
Es werden 20,0 ml Silbernitratlösung mit 10,0 ml 0,1 M Natriumchloridlösung versetzt, mit Wasser auf 50 ml verdünnt und 2,5 ml Salpetersäure 25 % zugegeben. Dabei fällt ein feinverteilter Niederschlag von Silberchlorid aus. Nun gibt man 2,5 ml Nitrobenzol zu, verschließt den Kolben und schüttelt kräftig. Das Silberchlorid ballt sich zu Klumpen zusammen und die Flüssigkeit klärt sich. Nach Zugabe von 3 ml Ammoniumeisen(III)-sulfatlösung wird unter gutem Rühren mit Ammoniumthiocyanat bis zur bleibenden, orangeroten Färbung titriert.
Bei meinem Versuch wurden 9,575 ml Maßlösung verbraucht, was bei einem Faktor von 1,036 einem korrigierten Verbrauch von 9,92 ml entspricht. Von den vorgelegten 19,9 ml Silbernitrat sollten 10 ml durch die Natriumchloridlösung gebunden worden sein, so daß 9,9 ml zurückzutitrieren waren. Der Fehler betrug hier also ca. 0,2 %.
Gehaltsbestimmung von meso-2,3-Dimercaptobernsteinsäure (Succimer)
50,0 mg der Substanz werden genau gewogen und mit Hilfe von 25 ml Ethanol 96 % in einen 100 ml-Messkolben gespült. Der Kolben wird in einem heißen Wasserbad erwärmt, bis sich das Succimer gelöst hat, dann werden 25,0 ml 0,1 N Silbernitratlösung zugegeben. Es bildet sich ein flockiger, zitronengelber Niederschlag. Der Kolben wird in kaltem Wasser abgekühlt, 1 ml Salpetersäure 25 % zugegeben und mit Wasser bis auf 100 ml aufgefüllt. Nun filtriert man durch ein kleines, trockenes (!) Filter zunächst in ein untergestelltes Bechergläschen. Die ersten 20 ml des Filtrats werden verworfen. Das nachfolgende Filtrat wird in einem 50-ml-Messkolben aufgefangen, bis dieser bis zur Eichmarke gefüllt ist (alternativ fängt man getrennt auf und pipettiert 2 x 25 ml ab). Die 50 ml des Filtrats werden in ein 250-ml-Becherglas gegeben und der Kolben mit 25 ml Wasser (in zwei Portionen) nachgespült. Nach Zugabe von 3 ml Salpetersäure 25 % und 4 ml Ammoniumeisen(III)-sulfatlösung wird mit Ammoniumthiocyanatlösung bis zur eben bestehen bleibenden, orangeroten Färbung titriert. Ein Milliliter 0,1 N Silbernitratlösung sind 4,555 mg Succimer äquivalent.
Ich habe die Bestimmung einmal mit der mir zur Analyse vorliegenden Rohsubstanz und einmal mit der durch Umkristallisieren gereinigten und bei 40 °C getrockneten Substanz gemacht. Vorgelegt waren 25 ml x 0,995 = 24,875 ml Silbernitratlösung. Gefunden habe ich:
1.) Rohsubstanz: 7,1 ml 0,1 N NH4SCN x 1,036 = 7,35 ml in der Hälfte der Gesamtmenge, insgesamt also 14,74 ml
Differenz: 24,875 – 14,7 = 10,175 ml
10,175 x 4,555 mg = 46,35 mg
Gehalt: 92,7 %
2.) Reinsubstanz: 6,8 ml 0,1 N NH4SCN x 1,036 = 7,04 ml in der Hälfte der Gesamtmenge, insgesamt also 14,08 ml
Differenz: 24,875 – 14,08 = 10,795 ml
10,795 x 4,555 mg = 49,17 mg
Gehalt: 98,34 %
Entsorgung:
Die silberhaltigen Niederschläge kann man abfiltrieren und durch Kochen mit Königswasser in Silberchlorid überführen, um dieses auf Silber zu verarbeiten. Wenn das zu umständlich erscheint, werden die Niederschläge alternativ mit dem Schwermetallabfall entsorgt
Erklärungen:
Die hier beschriebene maßanalytische Methode wurde von Ludwig Volhard (1834 – 1910), einem Neffen und Schüler Liebigs, entwickelt. Ursprünglich war sie zur Bestimmung des Silbers gedacht, wofür sie sich gut eignet. Das Verfahren ist aber auch sonst vielseitig einsetzbar, wenn man es mit der Technik der Rücktitration verbindet. Ein Vorteil der Methode besteht darin, dass sie in saurer Lösung ausgeführt werden kann. Grundlage ist die Bildung von schwerlöslichem Silberthiocyanat:
AgNO3 + NH4SCN ---> AgSCN + NH4NO3
Molmasse Ammoniumthiocyanat: 76,12 g/mol
Am Äquivalenzpunkt steigt die Konzentration des Thiocyanats in der Flüssigkeit sprunghaft an, so dass sich mit der als Indikator zugesetzten Eisen(III)-salzlösung rotes Eisen-III-thiocyanat bildet. Die optimale Menge an Ammoniumeisen-III-sulfatlösung (10 %ige) beträgt dabei ca. 5 ml auf 100 ml Flüssigkeit. Das Löslichkeitsprodukt des Silberthiocyanates beträgt LAgSCN = 6,8 x 10-13 mol2/l2, die Thiocyanationenkonzentration ist also 8,2 x 10-6 M. Bei einer Konzentration von 0,5 % Ammoniumeisen(III)-sulfat tritt der Farbumschlag auf, wenn c(SCN-) einen Wert von 10-5 M erreicht.
Bei der Bestimmung von Chlorid nach Volhard ergibt sich ein Problem: Silberthiocyanat ist schwerer löslich als Silberchlorid (LAgCl = 1,1 x 10-13 mol2/l2). Man muss also den Niederschlag abtrennen, da sich sonst ein Teil desselben wieder auflöst und ein zu hoher Verbrauch an Thiocyanat (falsch-niedrige Chloridmenge) resultiert. Wenn man den Niederschlag abfiltriert, bleibt allerdings ein Teil des nicht-umgesetzten Silbernitrats an denselben adsorbiert, so dass umgekehrt ein zu hoher Chloridwert gefunden wird. Es gibt verschiedene Möglichkeiten, dieses Problem in den Griff zu bekommen:
1. Man filtriert und bringt bringt eine konstante Korrektur in Höhe von 0,7 % des gefundenen Chloridwertes in Abzug
2. Man setzt ein mit Wasser nicht mischbares Lösungsmittel zu, das den Niederschlag einhüllt. Damit wird sowohl das Wiederauflösen als auch die Adsorptiopn von Silberionen aus der Lösung vermieden. Als besonders geeignet hat sich Nitrobenzol herausgestellt, da es schwerer als Wasser ist und den Niederschlag am Boden des Reaktionsgefäßes besser umhüllt. Auch Toluol oder Dibutylphtalat können verwendet werden.
3. Nach dem Kommentar zum DAB 9 lässt sich ein Mehrverbrauch an Thiocyanat vermeiden, wenn zu 100 ml Untersuchungslösung 5 ml einer 3,5 %igen wässrigen Lösung von Povidon zugesetzt werden.
Chloride werden nach Volhard nur bestimmt, wenn in saurer Lösung gearbeitet werden muss. In neutraler Lösung sind die Titrationen nach Mohr oder Fajans vorzuziehen. Dagegen können Bromide und Iodide titriert werden, ohne den Niederschlag abzutrennen, weil die entsprechenden Silberverbindungen gleich oder schwerer löslich sind als AgSCN. Wird Iodid titriert, so ist darauf zu achten, daß die Ammoniumeisen-III-sulfatlösung erst nach vollständiger Fällung des Iodids zugegeben wird, da sonst ein Teil desselben durch das dreiwertige Eisen zu freiem Jod oxidiert werden und der Bestimmung entgehen könnte
Besondere Bedeutung hat das Vorgehen nach Volhard - früher mehr als heute - bei der massanalytischen Bestimmung von organischen Stoffen, die mit Silber schwerlösliche Niederschläge bilden. So können bromierte Aliphaten nach Abspaltung des Broms in Form von Bromid oder die Sulfonamide (eine Gruppe von Antibiotika) durch die Bildung schwerlöslicher Silbersalze bestimmt werden. Ähnlich liegt der Fall bei der hier untersuchten Dimercaptobernsteinsäure:
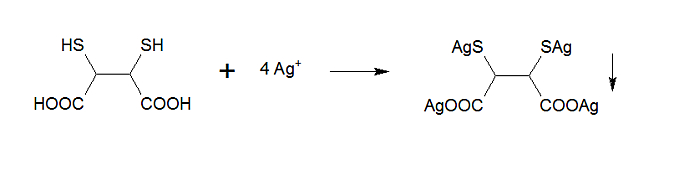
Molmasse 2,3-Dimercaptobernsteinsäure: 182,22 g
Äquivalentmasse: 45,55 g
Statt den Niederschlag ganz abzufiltrieren und auszuwaschen, was kaum quantitativ möglich ist, bestimmt man den Silberüberschuss besser in einem Aliqout des Filtrates. Die ersten 20 ml des Filtrates werden verworfen, da sich anfangs nicht definierbare Silbermengen an das Filtrierpapier adsorbieren. Die zurückzutitrierende Lösung soll mindestens 0,1 N Salpetersäure, unbedenklich auch mehr, enthalten.
Literatur:
Poethke, Walter: Praktikum der Massanalyse; 2. Auflage 1980, Verlag Harri Deutsch, Thun und Frankfurt/Main; ISBN 3-87144-535-5
Hartke, Mutschler (Hrsg.): DAB 9 Kommentar Band 1, Allgemeine Methoden und Reagenzien; Wissenschaftliche VerIagsbesellschaft MbH Stuttgart/Govi-Verlag Frankfurt 1987; ISBN 3-8047-0904-4
Bilder:

Einstellen der Ammoniumthiocyanatlösung


Schlierenbildung im Verlauf der Titration (links), Titrationsendpunkt mit orangeroter Färbung der Flüssigkeit (rechts) wobei der Niederschlag weiß bleibt


Effekt der Zugabe von Nitrobenzol (rechts) auf den Silberchloridniederschlag bei der Titration von Chlorid nach Volhard

Niederschlagsbildung von 2,3-Dimercaptobernsteinsäure mit Silbernitrat - am besten fällt man gleich im Messkolben, wo auf genau 100 ml aufgefüllt werden kann


links: die ersten 20 ml Filtrat werden getrennt aufgefangen und verworfen - rechts: 50,0 ml des weiteren Filtrates werden für die Rücktitration aufgefangen