Im Folgenden werden komplexometrische Titrationen mit Dinatrium-EDTA beschrieben. Mit dieser sehr vielseitigen Methode können zahlreiche Metalle quantitativ bestimmt werden. Im Alltag dient sie unter anderem dazu, die Wasserhärte festzustellen.
Material/Geräte:
Büretten 25 und 10 ml (Feinbürette), Trichter, Messkolben 250 und 100 ml, Messzylinder 100 und 10 ml, Bechergläser 250 ml, Kolbenhubpipette 1000 µl, Tropfpipetten, Analysenwaage, Universalindikatorpapier, Magnetrührer (optional)
Chemikalien:
di-Natriumethylendiamintetraacetat (Dinatrium-EDTA) p.a.

Eriochromschwarz T – Mischindikator (Verreibung 1 : 100 mit NaCl)

Murexid (Verreibung 1:100 mit NaCl)

Xylenolorange (Verreibung 1:100 mit KNO3)

Tiron (1,2-Dihydroxybenzol-3,5-disulfonsäure, Dinatriumsalz)

Sulfosalicylsäurelösung 20 %

Zinksulfat p.a.

Kaliumiodid

Natriumacetat
Ammoniaklösung 25 %



Ammoniumchlorid

Natronlauge 1M

Analysengut:
Zinkammoniumsulfat

Bleinitrat





Kobaltnitratlösung 5 %

Liquor Ferri sesquichlorati DAB 6 (Eisen-III-chloridlösung, 10 % Fe)

Quecksilber-II-nitratlösung “0,05 M“



Basisches Bismutnitrat
Leitungswasser
Versuchsdurchführung:
1. Herstellung der Reagenzien:
1.1 Maßlösungen:
0,1 M EDTA-Lösung: Das di-Natriumethylendiamintetraacetat (kurz: Dinatrium-EDTA) kommt üblicherweise als Dihydrat in den Handel. Wenn man die Packung frisch angebrochen hat, kann man das luftstabile Salz direkt als Urtiter verwenden und einfach einwiegen. Ist die Substanz dagegen schon eine Weile gelagert worden, so muss man davon ausgehen, dass sie etwas Feuchtigkeit enthält. In diesem Falle ist es besser, 10-12 g davon auf einem flachen Teller ausgebreitet für 4-6 Stunden auf 120-140 °C zu erhitzen (Trockenschrank) um das Kristallwasser und evtl. gebundenes Wasser auszutreiben. Man enthält dann das kristallwasserfreie Salz, das ebenfalls als Urtiter verwendet werden kann. Allerdings ist es hygroskopisch und im Laufe der Zeit bildet sich das Hydrat zurück, so dass man es am besten gleich verbraucht und den Rest vor einer späteren Verwendung erneut trocknet falls man es nicht absolut luftdicht (z.B. in Ampulllen eingeschmolzen) aufbewahrt.
Man wägt 8,405 g des wasserfreien Salzes (oder 9,305 g des Dihydrates) ab und spült die Substanz mit destilliertem Wasser quantitativ in einen 250 ml Messkolben (Wägegläschen mehrmals nachspülen!). Dann wird genau bis zur Ringmarke mit destilliertem Wasser aufgefüllt.
Die so hergestellte Maßlösung ist (eine ausreichend empfindliche Waage vorausgesetzt!) genau 0,1 molar und muss nicht eingestellt werden. Für viele Bestimmungen sind Lösungen niedrigerer Konzentration (0,05 M oder 0,02 M) vorteilhaft, die man sich durch Verdünnen aus der 0,1 M-Lösung oder durch eine entsprechende Einwaage (4,2025 g bzw. 1,681 g wasserfreie Substanz in 250 ml) herstellen kann. Der Titer ist über Jahre hinweg stabil, wenn die Lösung in einer Kunststoffflasche (Polyethylen) aufbewahrt wird. Glasflaschen sind ungeeignet, weil im Laufe der Zeit Calciumionen aus dem Glas abgegeben werden, wodurch der Titer der Maßlösung deutlich sinkt.
Für manche Bestimmungen braucht man das “Gegenstück“ zur EDTA-Lösung, nämlich eine Metallsalzlösung von bekanntem Gehalt, mit dem man im Überschuss zugesetztes EDTA zurück titrieren kann. Gut geeignet ist dafür Zinksulfat, das ein luftbeständiges Heptahydrat bildet (ZnSO4 x 7 H2O). Um eine 0,1 M Zinksulfatlösung zu erhalten, löst man 2,875 g des Salzes im Messkolben zu 100,0 ml.
1.2 Komplexindikatoren:
Eriochromschwarz T: man verwendet eine Verreibung des Farbstoffes mit Natriumchlorid p.a. (1:100), von der auf 100 ml Analysenlösung ca. 15-20 mg (eine Spatelspitze voll) zugefügt werden, bis eine deutliche Färbung zu erkennen ist. Im Arzneibuch wird ein Mischindikator verwendet, der außer Erio T noch etwas Methylorange enthält, hierdurch wird der Umschlag (Metallkomplex weinrot, freier Farbstoff grün) besser erkennbar. Mit Erio T muss im alkalischen Bereich bei einem pH von ca. 8-10 gearbeitet werden, wozu man einen Puffer zusetzt.
Murexid: Das war der erste Metallkomplexindikator, der entdeckt wurde. Auch vom Murexid benutzt man eine Verreibung 1:100 mit Natriumchlorid, die man etwas großzügiger dosieren muss. Auf 100 ml Flüssigkeit sind ca. 100 - 200 mg zuzusetzen, also ein bis zwei große Spatelspitzen. Der Umschlag erfolgt – abhängig von dem gebundenen Metallion - von orange bis gelb (Komplex) nach blauviolett (freies Murexid). Da der Farbumschlag oft nicht ganz scharf ist, arbeitet man am besten mit einer Vergleichslösung. Auch mit Murexid wird im basischen Bereich titriert.
Xylenolorange : Xylenolorange ist ein im sauren Milieu verwendbarer Indikator. Die Verreibung (1:100) wird hier mit Kaliumnitrat hergestellt. Auf 100 ml Lösung verwendet man 20-25 mg davon. Während die Komplexe violettrosa gefärbt sind, besitzt der freie Farbstoff eine gelbe Farbe.
Tiron (Natriumsalz der 1,2-Dihydroxybenzol-3,5-disulfonsäure): Tiron ist ein für die Bestimmung von Titan und Eisen (daher der Trivialname!) verwendeter Komplexindikator. Es bildet mit Eisen in saurem Milieu (pH 1-4) einen blaugrünen, im schwach sauren (pH 5-7) einen violetten und im schwach alkalischen (pH >7) Bereich einen orangefarbenen Komplex. Statt der üblichen 2%igen Lösung, die ca. 1 Jahr haltbar ist, kann das gut wasserlösliche Salz auch spatelspitzenweise direkt der Untersuchungslösung zugesetzt werden (ca. 40 mg/100 ml).
1.3 Ammoniak-Pufferlösung pH 10:
5,4 g Ammoniumchlorid und 35 ml Ammoniaklösung 25 % werden mit Aqua dest. auf 100 ml aufgefüllt. Zu 100 ml einer annähernd neutralen Flüssigkeit werden 3-5 ml der Pufferlösung gegeben. Nach seinem Erstbeschreiber heißt diese Puffermischung auch "Schwarzenbach-Puffer".
2. Komplexometrische Bestimmungen:
2.1. Bestimmung von Zink und Cadmium:
Zur Bestimmung dieser Metalle soll die Analysenlösung in 100 ml nicht mehr als 50 mg Zn2+ oder 100 mg Cd2+ enthalten (gegebenenfalls verdünnen). Man setzt Ammoniakpuffer und Erio T zu und titriert mit EDTA-Lösung bis zum Farbumschlag von rot nach grün, der sehr scharf erfolgt.
1 ml 0,1 M EDTA = 6,537 mg Zn2+ bzw. 11,24 mg Cd2+
1 ml 0,05 M EDTA = 3,269 mg Zn2+ bzw. 5,62 mg Cd2+
1 ml 0,02 M EDTA = 1,307 mg Zn2+ bzw. 2,248 mg Cd2+
Auf diese Weise kann der Gehalt der Zinksulfat-Maßlösung überprüft werden. Umgekehrt kann analysenreines Zink als Urtitersubstanz dienen, wenn man den Titer einer EDTA-Lösung prüfen will. Dazu wird eine Zinkgranalie von 300-500 mg genau gewogen, in 2-3 ml Salzsäure 25 % gelöst (das geht spontan ohne Erwärmen) und im Messkolben auf 100,0 ml aufgefüllt. Zwanzig Milliliter der Lösung werden wie oben angegeben titriert und der erwartete Verbrauch an Maßlösung (vorgelegte Zinkmenge in mg geteilt durch 6,537) durch den tatsächlichen Verbrauch geteilt, um den Titer zu erhalten.
Ich habe die Methode benutzt, um ein selbst hergestelltes Präparat von Zinkammoniumsulfat auf seine Zusammensetzung zu überprüfen. 200 mg des Salzes wurden abgewogen, in 90 ml Wasser gelöst, 5 ml Ammoniakpufferlösung und eine Spatelspitze Erio-T-Verreibung zugegeben und das ganze auf den Magnetrührer gestellt. Verbraucht habe ich bis zum Umschlag des indikators genau 5,00 ml Maßlösung entsprechend 32,69 mg Zink, was einem Anteil von 16,34 % entspricht (100,3% der Theorie). Bei einem Tropfen weniger (4,95 ml) hätte sich ein Gehalt von 99,3% ergeben. Die Verwendung einer 0,05 M-Lösung wäre vermutlich genauer gewesen.
Auf die gleiche Weise kann Magnesium bestimmt werden (max. 30 mg/100 ml). Ein Milliliter ml 0,1 M EDTA entspricht 2,431 mg Mg2+.

Titration von Zink


Farbänderung des Eriochromschwarz T - Mischindikators
2.2 Gesamthärte des Leitungswassers, Bestimmung von Calcium:
Um die Gesamthärte zu ermitteln, werden genau 100 ml der Wasserprobe mit 4 ml Ammoniakpufferlösung und 1 Prise Erio-T versetzt und mit 0,05 M oder 0,02 M EDTA bis zum Farbumschlag von weinrot nach blaugrün titriert.
1 ml 0,05 M EDTA = 2,8° dGH (deutsche Gesamthärte)
1 ml 0,02 M EDTA = 1,122° dGH
Zur Bestimmung von Calcium soll die Flüssigkeit maximal 50 mg Ca2+ in 100 ml enthalten und wird pro 100 ml mit 2 ml 1 N Natronlauge (falls sie sauer reagiert muss man zuvor neutralisieren!) sowie 100 mg Murexidverreibung versetzt. Dann titriert man mit EDTA von rosarot bis violett (Vergleichslösung!). Die Karbonathärte des Wassers ist zuvor durch Zusatz einer berechneten Menge 0,1 N Salzsäure und kurzes Kochen zu entfernen.
1 ml 0,1 M EDTA = 4,008 mg Ca2+
1 ml 0,05 M EDTA = 2,004 mg Ca2+
1 ml 0,02 M EDTA = 0,8014 mg Ca2+
Ich habe bei der Härtebestimmung unseres Leitungswassers 16,2 ml 0,02 M EDTA-Lösung verbraucht. Das Wasser hat somit 18,1 °dGH! Die Titration mit Murexid ergab für 100 ml HCO3--freies Wasser einen Verbrauch von einmal 12,3 und einmal 12,4 ml. Man darf davon ausgehen, dass Leitungswasser außer Calcium und Magnesium keine weiteren mit EDTA reagierenden Metalle enthält. Damit ergibt sich:
Summe Erdalkalien: 3,24 mmol/l (16,2 : 5)
Calcium : 2,46 mmol/l = 98,6 mg/l
Magnesium: (3,24 - 2,46 =) 0,78 mmol/l = 19 mg/l



Farbänderung des Erio-T-Mischindikators bei Titration mit 0,02 M EDTA (Bestimmung der Wasserhärte), das zweite Bild zeigt die Zwischenfarbe vor dem Umschlag nach Grün



Farbwechsel von Murexid bei Titration von Calcium. Der Umschlag ist nicht ganz leicht zu erkennen, weshalb eine Vergleichslösung vorteilhaft ist

Farbumschlag von Murexid bei pH 12 mit (links) und ohne Calcium (rechts)
2.3 Bestimmung von Blei und Quecksilber:
Blei und Quecksilber können unter Verwendung von Erio T mittels Rücktitration bestimmt werden.
Die Probe, die 10-200 mg Blei bzw. Quecksilber enthalten kann, wird mit Natronlauge annähernd neutralisiert, mit 20,0 ml 0,05 M EDTA-lösung versetzt (im Falle von Quecksilber bildet sich dabei kurzfristig ein weißer Niederschlag, der sich rasch wieder auflöst) und auf 90 bis 100 ml verdünnt. Nach Zugabe von Ammoniakpuffer und Erio T wird mit 0,05 M Zinksulfatlösung bis zum Farbumschlag des Indikators titriert, der diesmal umgekehrt von Grün nach Weinrot erfolgt. Werden dabei x ml Zinksulfatlösung verbraucht, so beträgt die durch den Anlayt gebundene Menge EDTA = 20-x. Bei kleinen Mengen verwendet man eine 0,02 M EDTA bzw. ZnSO4-Lösung.
1 ml 0,1 M EDTA = 20,06 mg Hg2+ bzw. 20,72 mg Pb2+
1 ml 0,05 M EDTA = 10,03 mg Hg2+ bzw. 10,36 mg Pb2+
Von selbst hergestelltem Bleinitrat wurden 200 mg abgewogen und in 50 ml Wasser gelöst. Dann wurde mit 20,0 ml 0,05 M EDTA-Lösung versetzt und mit destilliertem Wasser auf etwa 90 ml aufgefüllt. Nach Zugabe der üblichen Mengen an Ammoniakpufferlösung und Erio-T-Mischindikator wurde mit 0,05 M Zinksulfatlösung titriert. Der Verbrauch betrug 8,00 ml Zinklösung, was bedeutet, dass 12,00 ml der EDTA-Lösung durch das Blei des Präparates gebunden worden waren. Bei einer Molmasse von 331,2 g für Bleinitrat ergibt sich, dass 1 ml 0,05 M EDTA = 16,56 mg Pb(NO3)2 entspricht. Analysenergebnis: 198,7 mg, mithin ein Gehalt von 99,4 % im Präparat.
Eine selbst hergestellte Quecksilber-II-nitratlösung von 0,05 M Gehalt, die ich für die Chloridtitration benötigte, wurde analog auf ihren Gehalt geprüft: 10,0 ml wurden neutralisiert, mit 20,0 ml 0,05 M EDTA versetzt und mit 0,05 M Zinksulfatlösung zurücktitriert. Der Verbrauch von 10,1 ml bedeutete, dass meine Quecksilberlösung 9,9 ml EDTA verbraucht hatte. Der Faktor betrug damit 1,01.
Bei der Titration von Quecksilber kann zusätzlich eine Kontrolle erfolgen, ob das Salz rein ist. Dazu gibt man zur austitrierten Lösung etwa 1 g Kaliumiodid. Der Indikator schlägt wieder nach Grün um, und es wird erneut mit Zinksulfat bis zur Rückkehr der roten Färbung titriert. Wenn keine anderen Schwermetalle zugegen sind, muss der Verbrauch an Zinksulfatlösung bei der zweiten Titration mit dem bei der ersten Titration ermittelten Verbrauch an EDTA übereinstimmen. Dies war bei mir der Fall: ich habe 9,925 ml Zinksulfatlösung verbraucht.



Rücktitration von Quecksilber: die grüne Farbe schlägt am Endpunkt nach Rot, und nach Zugabe von Kaliumiodid erneut nach Grün um
2.4 Bestimmung von Kupfer:
Kupfer wird mit Murexid in schwach ammoniakalischer Lösung (pH ca. 8 ) titriert. Dazu wird die nicht mehr als 30 mg Cu2+ enthaltende Lösung tropfenweise mit verdünnter Ammoniaklösung (konzentrierten Ammoniak 1:10 verdünnen, Gebrauchslösung ca. 2,5 %ig – 1,5 M) versetzt, bis die anfänglich sich bildende Trübung (durch Kupferhydroxid) eben wieder gelöst ist. Ein Überschuss ist zu vermeiden. Nach Zugabe vom Murexid titriert man mit EDTA bis zum Farbumschlag von braungelb nach violett, wobei eine ziegelrote Übergangsfarbe auftritt (Vergleichslösung!)
1 ml 0,1 M EDTA = 6,355 mg Cu2+
1 ml 0,05 M EDTA = 3,178 mg Cu2+
1 ml 0,02 M EDTA = 1,271 mg Cu2+
Für meine Leuchtsteinfabrikation hatte ich eine alkoholische Kupfernitratlösung hergestellt, die 1 mg Kupfer pro ml enthalten sollte (0,1%). Um den Gehalt zu überprüfen, wurden 10 ml der Lösung mit 50 ml Wasser verdünnt, mit Ammoniak versetzt, Murexid zugegeben und titriert. Der Verbrauch betrug 8,025 ml 0,02 M EDTA. Das entspricht 10,2 mg Kupfer und meine Lösung war somit 0,102 %ig.



Farbwechsel von Murexid bei der Titration von Kupfer

Vergleichslösungen zum Farbumschlag von Murexid mit (links) und ohne Kupfer (rechts)
2.5 Bestimmung von Kobalt:
Die Bestimmung von Kobalt ist der des Kupfers sehr ähnlich, der Umschlag ist aber schwerer zu erkennen. Die Lösung darf nicht zu viel freies Ammoniak enthalten. Konkret geht man folgendermaßen vor:
Die bis zu 50 mg Kobalt enthaltende Lösung wird auf 100 ml aufgefüllt und mit einer Spatelspitze (ca. 150 - 200 mg) Ammoniumchlorid versetzt. Nach Zugabe von Murexid bildet sich eine orange-rötliche Farbe aus. Nun wird verdünntes Ammoniak (ca. 1,5 M bzw. 2,5 %) zugetropft, bis eine rein gelbe Färbung vorliegt (ca. 3 Tropfen), und die Titration begonnen. Bald wird das Gelb wieder dunkler, und es werden unter gutem Rühren wiederholt 2-3 Tropfen Ammoniak zugefügt, wobei sich die Farbe jedes Mal wieder nach Gelb aufhellt. Wenn Die orangerote Farbe auf Ammoniakzusatz nicht mehr verschwindet ist der Endpunkt fast erreicht. Man gibt nochmals 3 Tropfen Ammoniak zu und titriert bis zum Erreichen einer violettroten Farbe (Vergleichslösung!)
1 ml 0,1 M EDTA = 5,893 mg Co2+
1 ml 0,05 M EDTA = 2,947 mg Co2+
1 ml 0,02 M EDTA = 1,179 mg Co2+
In meinem Reagenzienschrank steht eine Kobaltnitratlösung 5 % für Lötrohranalysen. Bezieht sich der Gehalt auf das kristallwasserhaltige, oder das wasserfreie Salz? Es wurden 1000 µl der Lösung nach der oben beschriebenen Methode mit 0,02 M EDTA titriert und ein Verbrauch von 13,8 ml gefunden. Das ergibt 16,25 mg Kobalt, die 50,47 mg Co(NO3)2 entsprechen. Die Gehaltsangabe bezieht sich also auf das wasserfreie Salz.




Farbwechsel von Murexid bei der Titration von Kobalt. oben: neutrale Lösung (links) und nach Zugabe von 3 Tropfen verdünntem Ammoniak
unten: Rückbildung der orangegelben Farbe während der Titration (links) - hier muss erneut Ammoniak zugegeben werden bis die gelbe Farbe wiederkehrt. Schließlich schlägt der Indikator nach Violett um (rechts)
2.6 Bestimmung von Bismut:
Bismut kann in saurer Lösung auch neben anderen Kationen bestimmt werden. Die Konzentration soll nicht über 60 mg/100 ml betragen. Als Indikator dient Xylenolorange, der ideale pH liegt bei etwa 2. Stark saure Lösungen werden mit etwas Natriumacetat abgestumpft (pH-Papier!). Nachdem der Indikator zugefügt wurde, titriert man mit EDTA bis die Farbe von Violettrot nach Gelb umschlägt.
1 ml 0,1 M EDTA = 20,90 mg Bi3+
1 ml 0,05 M EDTA = 10,45 mg Bi3+
1 ml 0,02 M EDTA = 4,18 mg Bi3+
Untersucht habe ich eine Probe basisches Bismutnitrat. Es wurden 100 mg abgewogen und in einer Mischung aus 0,4 ml Salpetersäure und 1 ml Wasser unter Erwärmen gelöst. Die Lösung wurde auf 100 ml verdünnt und Xylenolorange zugegeben. Bis zum Farbumschlag – der sehr scharf erfolgte – wurden 17,1 ml 0,02 M EDTA-Lösung verbraucht. Das entspricht 71,48 mg Bismut und einem Gehalt von 71,5 %.



Farbwechsel von Xylenolorange bei der Titration von Bismut. Obwohl eine Zwischenfarbe auftritt, ist der Umschlag nach Gelb ziemlich scharf zu erkennen
2.7 Bestimmung von Eisen-III:
Auch Eisen wird in saurer Lösung bestimmt, und zwar als Fe3+. Zweiwertiges Eisen muss zuvor durch Kochen mit Wasserstoffperoxid in die dreiwertige Form überführt werden. Es werden bis zu 100 mg/100 ml titriert, der pH wird durch Zusatz von wenig Natriumacetat auf 2-3 eingestellt (man darf nicht zu viel nehmen, da sich sonst ein störender, roter Eisen-II-acetatkomplex bildet). Wenn viel freie Säure vorliegt, wird diese zuvor mit Ammoniak teilweise neutralisiert. Als Indikator kann Sulfosalicylsäure verwendet werden, die mit Fe3+ eine tiefviolette Färbung ergibt. Auf 100 ml gibt man 2 Tropfen einer 20 %igen Lösung der Substanz zu. Mit EDTA wird dann bis zur reinen Gelbfärbung – der EDTA-Eisen-Komplex hat eine zitronengelbe Farbe – titriert.
Bei der Verwendung von Tiron als Indikator setzt man 2 ml einer 2%igen Lösung - oder einfacher eine große Spatelspitze (30-40 mg) auf 100 ml Titrierflüssigkeit zu. Auch hier soll der pH-Wert 2-3 betragen. Die dunkel-grünblaue Lösung hellt sich gegen Ende der Titration zu Grün auf. Der Übergang nach rein gelb ist gut zu erkennen. Gegen Ende muss langsam titriert werden, da sich die Färbung nach Zugabe der letzten Tropfen Maßlösung relativ langsam verändert.
1 ml 0,1 M EDTA = 5,585 mg Fe3+
1 ml 0,05 M EDTA = 2,7925 mg Fe3+
1 ml 0,02 M EDTA = 1,117 mg Fe3+
Mittels Jodometrie hatte ich bereits eine alte Probe des DAB 6-Präparates Liquor Ferri sesquichlorati untersucht, das 10,3 Gewichts% Eisen enthielt, entsprechend 13,47 %(m/V). Der Bequemlichkeit halber wollte ich eine Konzentration von 10 %(m/V) Eisen haben und hatte die Lösung entsprechend verdünnt. Hat sie jetzt die gewünschte Stärke? Es wurden 1000 µl mit 120 ml Aqua dest verdünnt und eine Spatelspitze Natriumacetat zugegeben, worauf eine dunkelgelbe Farbe entstand, die nach Zugabe von Sulfosalicylsäure fast schwarzviolett wurde. Bei der Titration mit 0,1 M EDTA hellte sich die Farbe gegen Ende immer mehr auf und ging über Braun und Orange schließlich in rein Gelb über. Der Verbrauch von 18,45 ml entspricht 103,04 mg Eisen und somit einem Gehalt von 10,3 %(m/V).


Vorbereitung der Titration von Eisen-III. die Analysenlösung (links) ist blassgelb gefärbt und nimmt nach Zugabe von Natriumacetat (rechts) eine dunklere Farbe an



Farbwechsel bei der Titration von Eisen mit Sulfosalicylsäure als Indikator



Farbwechsel unter Verwendung von Tiron als Indikator
Entsorgung:
Die schwermetallhaltigen Analysenlösungen werden mit den anorganischen Abfällen entsorgt. Überschüssige EDTA-Lösung kann ins Abwasser gegeben werden.
Erklärungen:
Unter Komplexen versteht man in der Chemie Moleküle, in denen ein zentrales Metallatom von einem oder mehreren Molekülen oder Ionen umgeben ist, die Liganden genannt werden. Dabei wirken die an das Metall koordinierten Liganden als Lewis-Basen, die ein freies Elektronenpaar zur Verfügung stellen, über welches sie mit unbesetzten Valenzorbitalen des Metallions in Wechselwirkung treten. Komplexbildung ist bei den Ionen der meisten schweren, und vor allem der Übergangsmetalle, die Regel. So liegen Eisen(III)-ionen in wässriger Lösung als Hexaaquokomplexe [Fe(H2O)6]3+ vor. Die Anzahl der an ein Metallatom koordinierten Liganden heißt Koordinationszahl. Sie beträgt häufig 6 (Eisen, Kobalt, Nickel, Platin-IV, Chrom-III) oder 4 (Kupfer, Gold-III, Blei, Quecksilber, Zink).
Die Stabilität eines Komplexes, das heißt inwieweit das Gleichgewicht der Reaktion
Me + n X <---> [MeXn]
auf der rechten Seite zu liegen kommt, kann nach dem Massenwirkungsgesetz durch die Konstante
\(\frac{[MeX^n]}{[Me] [X]^n}= K\)
dargestellt werden. Je größer K, desto weniger dissoziiert - und somit stabiler - ist der Komplex. Nun gibt es einzähnige und mehrzähnige Liganden. Bei den letzteren handelt es sich um Moleküle, die an mehr als nur eine Koordinationsstelle des Metallatoms binden. Komplexe mit mehrzähnigen Liganden sind in der Regel viel stabiler also solche mit einzähnigen. Diese Tatsache bildet die Grundlage der Komplexometrie.
Die als Komplexbildner eingesetzte Ethylendiamintetraessigsäure (EDTA), hat folgende Struktur:
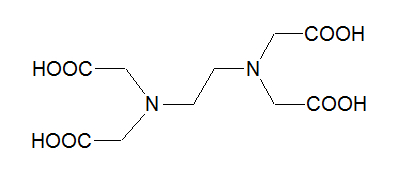
Das Molekül besitzt vier COOH-Gruppen und kann somit einfach bis vierfach negativ geladene Anionen bilden. In Reaktionsgleichungen wird EDTA oft mit "Y" bezeichnet. Das di-Natriumethylendiamintetraacetat wäre somit Na2H2Y und das EDTA-Anion würde man als Y4- formulieren. Nach der neueren Nomenklatur wird das Anion, wenn es als Ligand in einem Komplex vorliegt, in runden Klammern klein geschrieben, also mit "(edta)" bezeichnet, wärend EDTA die freie Säure bzw. ihre Anionen darstellt. EDTA ist ein sechszähniger Ligand: sowohl über die vier COO--Gruppen, als auch über die freien Elektronenpaare der Stickstoffatome, kann das Molekül an ein Metallion binden. Dabei umschließt es das Zentralatom wie eine Kralle oder eine dreidimensionale Klammer wobei eine oktaedrische Struktur entsteht, die aus fünf Fünferringen besteht:
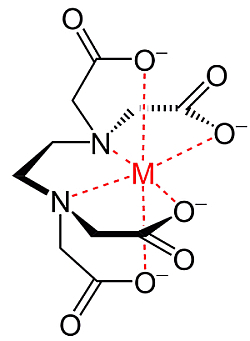
(Bild aus Wikipedia)
Nach dem griechischen Wort chelé, das Kralle oder Krebsschere bedeutet, werden diese Komplexe Chelate und Moleküle wie EDTA Chelatbildner genannt. Chelatbildner "krallen" sich sozusagen die Metallionen, und die entstehenden Komplexe sind im Allgemeinen sehr viel stabiler, als die die Komplexe des betreffenden Metalls mit einzähnigen Liganden, die durch den Chelatbildner vollständig verdrängt werden.
Quelle: Waselowsky (siehe Literatur)
Dieser sogenannte Chelateffekt wird auf zwei Wegen erklärt.
Das erste Argument ist ein kinetisches: wenn ein mehrzähniger Ligand mit einer Koordinationsstelle an ein Metallion bindet, so ist es aufgrund der räumlichen Nähe der anderen Koordinationsstellen sehr wahrscheinlich, dass auch diese an das Zentralatom binden. Die Bildung eines Chelatkomplexes ist gegenüber der eines Komplexes mit mehreren einzähnigen Liganden bevorzugt, weil beim letzteren immer mehre Moleküle des Liganden gleichzeitig am "richtigen Ort“ sein müssen – beim Chelat dagegen nur eines.
Das zweite Argument ist thermodynamischer Natur und erklärt den Chelateffekt als Entropieeffekt. Nach dem zweiten Hauptsatz der Thermodynamik streben Prozesse einem Endzustand größtmöglicher Unordnung zu, weil dieser eine höhere Wahrscheinlichkeit beinhaltet, als ein geordneter Zustand. Nun scheint ein Chelatkomplex ein höchst geordnetes Gebilde zu sein. Betrachtet man aber die Reaktionsgleichung (hier am Beispiel der Komplexierung von Eisen):
[Fe(H2O)6]3+ + H2EDTA2- ---> [Fe[edta)]- + 2 H3O + + 4 H2O
so bemerkt man, dass, wo auf der linken Seite des Gleichgewichts zwei Teilchen stehen, sich auf der rechten Seite deren sieben finden! Die Unordnung - die Entropie - nimmt bei der Chelatbildung zu, daher ist diese thermodynamisch begünstigt.
Es gibt aber Fälle, in denen diese Argumente offenbar nicht greifen. So lassen sich Schwermetalle, welche die Bestimmung von Erdalkalien stören würden, durch Cyanid so stabil komplexieren, dass sie von EDTA nicht erfasst werden. Umgekehrt können Erdalkaliionen durch Flurid maskiert werden. Und mit Iodid lässt sich Quecksilber aus seinem EDTA-Komplex in den Tetraiodmercurat-Komplex überführen (siehe unten bei der Bestimmung von Quecksilber). In allen diesen Fällen sind die Komplexe mit den einzähnigen Liganden stabiler, als die Chelatkomplexe.
In der Maßanalyse ist von praktischer Bedeutung, dass bei der Verwendung von di-Natrium-EDTA im Laufe der Komplexbildung Wasserstoffionen frei werden, und der pH-Wert der Lösung sinkt. Dies kann einmal die Färbung des Indikators beeinflussen, aber auch das Reaktionsgleichgewicht in Richtung Dissoziation des Komplexes verschieben, wenn dieser nicht sehr stabil (also K nicht sehr groß) ist. Der pH-Wert spielt daher in der Komplexometrie eine große Rolle. Nur Metalle, deren EDTA-Komplexe sehr stabil sind - z.B. Eisen-III und Bismut - können im sauren Milieu bestimmt werden. Gleichzeitig ist dadurch eine Bestimmung neben Analyten möglich, deren Komplexe erst im basischen Bereich stabil sind. So stören Erdalkalien bei der Titration von Eisen und Bismut mit EDTA im sauren Milieu gar nicht. Bei ihnen ist die Komplexbildung erst bei pH-Werten um 10 als vollständig zu betrachten.
Metall- oder Komplexindikatoren sind organische Farbstoffe, die mit den zu bestimmenden Metallen ihrerseits Komplexe bilden, die aber weniger stabil als die entsprechenden EDTA-Komplexe sind. Da die Bindung des Metalls die Elektronenverteilung des Farbstoffmoleküls verändert, ändert sich auch dessen Absorptionsspektrum und damit die Farbe.
zur Bestimmung von Zink, Cadmium und Magnesium:
Diese zweiwertigen Ionen bilden im mäßig alkalischen Bereich bei einem pH von 10 stabile EDTA-Komplexe und lassen sich gut mit Eriochromschwarz T als Indikator titrieren. Der zugesetzte Ammoniakpuffer fängt die bei der Umsetzung entstehenden H+-Ionen ab. Zink und Kadmium können bis zu einem pH von 7 genau bestimmt werden. Das Arzneibuch schreibt zur Titration von Zink Xylenolorange vor und arbeitet in schwach alkalischem Medium durch Zusatz von Hexamethylentetramin (Methenamin). Das von mir untersuchte Zinkammoniumsulfat ist ein definiertes Doppelsalz der Formel Zn(NH4)2(SO4)2 x 6 H2O und enthält 16,28 % Zink.
zur Bestimmung der Wasserhärte und von Calcium
Leitungswasser (bzw. Grundwasser) enthält Calcium und Magnesium als Hydrogencarbonate und Sulfate gelöst, daneben kommen häufig Chlorid, Natrium und Spuren von Nitrat vor. Durch komplexometrische Titration lässt sich die Summe der Erdalkalien, die Gesamthärte, einfach bestimmen. Calcium bildet zwar mit Erio T keinen für die Bestimmung ausreichend stabilen Komplex. Sind aber gleichzeitig Spuren von Magnesium zugegen, so ist die Titration exakt, weil zunächst das Calcium gebunden wird und dann das Magnesium, das seinerseits mit Erio T einen scharfen Umschlag gibt.
Man kann die Gesamthärte in mmol/l angeben oder auf sogenannte Härtegrade umrechnen. Ein “Grad deutsche Härte“ ist diejenige Menge eines Erdalkalisalzes, die 10 mg Calciumoxid pro Liter Wasser äquivalent ist. Nach der aktuellen Definition - die im Wasch- und Reinigumgsmittelgesetz festgelegt ist - gilt Wasser mit weniger als 8,4°dGH (Gesamthärte) als “weich“ und mit mehr als 14 °dGH als “hart“, der Bereich dazwischen wird als “mittel“ bezeichnet (der früher verwendete Begriff “sehr hart“ für Wasser mit mehr als 21 °dGH ist entfallen).
Calcium lässt sich mit einem geeigneten Indikator im Leitungswasser bei einem pH von >12 selektiv neben Magnesium bestimmen, sofern letzteres nicht in allzu großem Mengen vorhanden ist. Es kann Murexid oder Calconcarbonsäure verwendet werden. Carbonate und Hydrogencarbonate müssen vorher entfernt werden, weil sonst bei dem hohen pH evtl. Calciumcarbonat ausfällt. Das Arzneibuch schreibt Calconcarbonsäure als Indikator vor. Bei meinen Versuchen fand ich den Umschlag damit – er erfolgt von violett nach blau - aber auch nicht leichter zu erkennen, als mit Murexid. Wenn Magnesium in größerer Menge vorliegt, fällt es als Magnesiumhydroxid aus und reißt einen Teil des Calciums mit sich, wobei falsch-niedrige Werte erhalten werden. In diesem Fall verwendet man einen EDTA-Überschuss, alkalisiert, filtriert vom Niederschlag ab und titriert das nicht gebundene EDTA in einem Aliquot des Filtrats mit einer eingestellten Calciumlösung zurück.
zur Bestimmung von Blei
Blei wird über die Rücktitration bestimmt, weil es bei dem erforderlichen, alkalischen pH-Wert ausfällt. Man erhält bei dem oben beschriebenen Vorgehen den sehr scharfen Umschlag des Zinks an Erio T. Alternativ kann durch Zusatz von etwas Kalium-natrium-tratrat (etwa 5 ml einer 1 M Lösung auf 100 ml) direkt bei pH 10 titriert werden. Blei lässt sich dabei auch neben anderen Schwermetallen bestimmen, indem vor der Titration etwas Kaliumcyanid zugegeben wird. Dabei bilden Cu2+, Zn2+, Cd2+, Hg2+, Fe3+, Co2+ und Ni2+ kaum dissoziierte Cyanokomplexe, die durch EDTA nicht zersetzt werden.
zur Bestimmung von Quecksilber:
Auch Quecksilber wird am besten über Rücktitration bestimmt. Hier ergibt sich noch die Möglichkeit, dass auf die Anwesenheit anderer Schwermetalle geprüft werden kann, indem man zu der eben austitrierten Lösung Kaliumiodid gibt. Entgegen den oben dargelegten allgemeinen Anschauungen über Komplexstabilität ist der Tetraiodmercuratkomplex nämlich viel stabiler als der Hg-EDTA-Komplex, und es wird eine dem gebundenen Quecksilber äquivalente Menge EDTA freigesetzt,
[Hg(edta)]2- + 4 KI ---> K2[HgI4] + 2 K+ + EDTA4-
die dann erneut mit Zinksulfatlösung titriert wird. Man erhält also bei der ersten Titration die Gesamtmenge des verbrauchten EDTA, bei der zweiten nur diejenige, die durch das Hg gebunden worden war. Liegt ein reines Quecksilberpräparat vor, so müssen beide Werte gleich sein.
zur Bestimmung von Kupfer:
Kupfer wird bei pH von ca. 8 mit Murexid als Indikator titriert. Bei diesem pH stören geringe Mengen Erdalkaliionen nicht. Liegen sie in höherer Konzentration vor, können sie durch Zugabe von Natriumfluorid maskiert werden.
zur Bestimmung von Bismut:
Bismut bildet einen der stabilsten EDTA-Komplexe überhaupt (pK 27,94) und kann deswegen sehr selektiv in saurer Lösung titriert werden, wo andere Metalle mit EDTA keine stabilen Komplexe bilden. Die Lösung darf allerdings keine Chloridionen enthalten, weil sonst Bismutoxichlorid (BiOCl ) ausfällt. In diesem Falle muss ein EDTA-Überschuss eingesetzt, und mit einer eingestellten Bismutnitratlösung zurücktitriert werden.
Das oben analysierte basische Bismutnitrat ist ein sehr altes pharmazeutisches Präparat, das früher Magisterium Bismuthi, “Das Meisterstück des Wismuths“, genannt wurde. Es wird durch Eintragen einer Anreibung von Bismutnitrat in siedendes Wasser dargestellt. Ältere Pharmakopöen (das DAB 6) schrieben einen Bi-Gehalt von 70,9-73,6 % vor, der gravimetrisch (über Bismut-III-oxid) ermittelt wurde. Im europäischen Arzneibuch findet man für das basische Bismutnitrat die Summenformel 4[BiNO3(OH)2], BiO(OH). Wenn man daraus den Gehalt an Bismut berechnet, so erhält man 71,47 %, was exakt mit meinem Analysenergebnis übereinstimmt. Dennoch scheint das mehr ein Zufall zu sein, denn auch die Ph. Eur. lässt einen schwankenden Bismutgehalt von 71,0 bis 74,0 % zu.
zur Bestimmung von Eisen:
Auch Eisen kann in kräftig saurem Milieu neben zweiwertigen Kationen, Al3+ oder Cr3+ titriert werden. Sulfosalicylsäure bildet mit Fe3+ einen tiefvioletten Komplex, der weniger stabil ist, als der entsprechende EDTA-Komplex. Alternativ kann man auch einfache Salicylsäure (ca. 200 mg auf 100 ml) verwenden, muss dann aber bei einem pH von etwa 4 arbeiten. In der Literatur ist angegeben, bei Verwendung von Tiron solle die Lösung auf 40-50°C erwärmt werden. Bei meinen vergleichenden Versuchen trat der Umschlag damit aber früher ein als bei Zimmertemperatur und deutlich früher als bei Verwendung von Sulfosalicylsäure, so daß falsch-niedrige Werte erhalten wurden.
zur Bestimmung von Kobalt:
Kobalt muss in schwach alkalischer Lösung titriert werden, weil bei zu hoher Ammoniakkonzentration Kobalthydroxid ausfällt oder sich durch Oxidation der sehr stabile Hexamminkobalt(III)-Komplex (pK 35,1!) bilden kann, der durch EDTA nicht mehr zerlegt wird. Andererseits ist der Kobalt-Murexid-Komplex bei zu niedrigen pH-Werten orangerot gefärbt, was die Erkennung des Umschlagspunktes (zur violettroten Farbe des freien Murexids) erschwert. Daher wird gerade immer so viel Ammoniak zugegeben, dass der Indikatorkomplex seine gelbe Farbe behält. Weil während der Bindung des Kobalts an das EDTA Wasserstoffionen frei werden, und die Mischung nur sehr gering gepuffert ist, muss immer wieder Ammoniak nachdosiert werden.
Auf analoge Weise kann man auch Nickel titrieren. Auch hier vermeidet man anfangs hohe pH-Werte, damit kein Nickelhydroxid ausfällt. Im Unterschied zum Kobalt gibt man aber kurz vor dem Endpunkt reichlich Ammoniak (etwa 10 ml konzentrierte Ammoniaklösung auf 100 ml!) zu, weil der Umschlag des Indikators mit Nickel im stark basischen Bereich am schärfsten ist.
Literatur:
Poethke, Walter: Praktikum der Maßanalyse; 2. Auflage 1980, Verlag Harri Deutsch, Thun und Frankfurt/Main; ISBN 3-87144-535-5
Waselowsky, Kurt: mit Meßkolben und Bürette – kleines Praktikum der Maßanalyse; Kosmos – Franck’sche Verlagshandlung Stuttgart 1987; ISBN 3-440-05719-4
Deutsches Arzneibuch, 6. Ausgabe 1926, Nachdruck 1951
Europäisches Arzneibuch, 7. Ausgabe 2011