Vanillin und sein Analog Ethylvanillin zeichnen sich durch mehrere Reaktivitätszentren im Molekül aus. Diese sind vor allem die Aldehyd-Gruppe, das Phenol und der aktivierte und elektronenreiche aromatische Ring. Im ersten Teil meines Projekts hatte ich bereits die OH-Gruppe des Vanillins und Ethylvanillins mit Essigsäure bzw. Benzoesäure verestert, um sie zu schützen. Weiterhin wurden in Position 5 halogenierte Derivate synthetisiert. Diese werden in Zukunft Verwendung zur Synthese komplizierterer vanilloider Stoffe finden. Neben der Esterbildung kann die OH-Gruppe außerdem verethert werden. Einige solche Verbindungen sollen im Zuge dieses 2. Teils des Projekts hergestellt werden. Diese zeichnen sich wie die Ausgangsstoffe durch jeweils charakteristische Gerüche aus. So ist Veratrumaldehyd (3,4-Dimethoxybenzaldehyd, in diesem Artikel nicht behandelt) ein weit verbreiteter Duftstoff mit holzig-vanilliger Note.
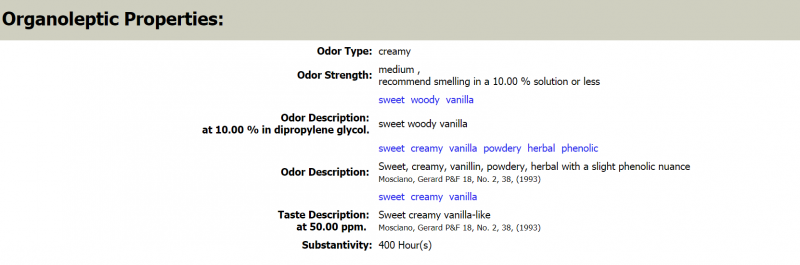
Geruchseigenschaften des Veratrumaldehyds (Quelle: thegoodscentscompany.com).
Geräte:
Bechergläser, Erlenmeyerkolben, Rundkolben, Rückflusskühler, Magnetheizrührer, Öl- oder Sandbad, Scheidetrichter, Rotationsverdampfer, Filterzubehör, Möglichkeit zur Vakuumtrocknung, Zubehör für die Dünnschichtchromatographie, UV-Lampe.
Chemikalien:
Vanillin

Ethylvanillin

Ethylbromid



1-Butyliodid


Aceton


Kaliumcarbonat, wasserfrei

Kaliumiodid

Ethylacetat


Toluol



Natronlauge 1M

O-Ethylvanillin

O-Ethylethylvanillin

O-Butylvanillin

Hinweis: Die verwendeten Alkylierungsmittel sind giftig! Die krebserregende Wirkung von Ethylbromid wurde im Tierversuch bewiesen. Letzteres ist zudem hochflüchtig. Es muss in einem Abzug oder im Freien gearbeitet werden.
Durchführung:
4-Ethoxy-3-methoxy-benzaldehyd (O-Ethylvanillin):
In einem 500 ml Rundkolben werden 30,4 g (0,20 mol) Vanillin in 200 ml Aceton gelöst und unter Rühren mit 27,6 g (0,20 mol) wasserfreiem Kaliumcarbonat und 5,00 g Kaliumiodid versetzt, wobei nach einiger Zeit eine gelbliche Suspension entsteht. Dann werden 21,8 g (14,9 ml, 0,20 mol) Ethylbromid in einem Schwung hinzugegeben. Sofort wird ein Rückflusskühler aufgesetzt und die Mischung für 12 Stunden im Sandbad rückflussgekocht, wobei das Kühlwasser eine Temperatur zwischen 0 und 5 °C haben sollte. Auf der Öffnung des Rückflusskühlers wird dabei ein Septum mit eingestochener Kanüle (Druckausgleich) angebracht. Ist das Vanillin nach den 12 Std. noch nicht vollständig umgesetzt (wie in meinem Fall) werden weitere 11 g Ethylbromid eingebracht und weiter gekocht. Schließlich lässt man die Reaktionsmischung leicht abkühlen und filtriert unlösliche Bestandteile ab. Das Lösungsmittel wird am Rotationsverdampfer abgezogen und der erhaltene gelbe Rückstand in Ethylacetat aufgenommen. Die Lösung wird im Scheidetrichter mit Wasser und dann 3 x ausgiebig mit 1 M NaOH-Lösung (bis keine Gelbfärbung der wässrigen Phase mehr auftritt) gewaschen und schließlich über Natriumsulfat getrocknet. Letzteres wird nach ca. 15 Min. abfiltriert und das Filtrat eingedampft. Die erhaltenen gelblichen Kristalle werden aus ca. 25 ml heißem Toluol umkristallisiert, wobei schöne, farblose Kristalle entstehen.
Ausbeute: 13,5 g (38% d.Th.)
Geruch: Leicht mild-holzig-herber Geruch mit sehr schwacher Ähnlichkeit zu Vanillin.

Noch unerhitztes Reaktionsgemisch.
Das Ethylbromid.

Rückflusskochen der Mischung.

DC-Analyse nach 12 Stunden (Petrolether/EtOAc 3:1).

Ausgeschütteltes Vanillin-Phenolat färbt wässrige Phase gelb.

Rohprodukt aus EtOAc abrotiert.

Umkristallisiertes Produkt.
3,4-Diethoxybenzaldehyd (O-Ethylethylvanillin):
Ähnlich wie in der ersten Vorschrift werden 16,6 g (0,10 mol) Ethylvanillin, 13,8 g (0,10 mol) Kaliumcarbonat, 8,30 g Kaliumiodid und 13,5 g (0,125 mol) Ethylbromid in ca. 150 ml Aceton unter Eiskühlung des Kühlwassers rückflussgekocht. Nach 14 Stunden (nahezu vollständiger Umsatz schien erreicht) wird die abgekühlte Suspension filtriert, das Filtrat einrotiert und der Rückstand in Ethylacetat aufgenommen. Die erhaltene Lösung wird mit Wasser und 3 x mit ausreichend 1 M NaOH gewaschen und über Natriumsulfat getrocknet. Das Filtrat wird vom Lösungsmittel befreit und der Rückstand über Nacht vakuumgetrocknet. Es ergibt sich eine leicht gelbliche, ölige Flüssigkeit mit einem Schmelzpunkt von 22 °C, die aber nur widerwillig zu kristallisieren scheint. Nach Ankratzen des Kolbens von innen, Kühlung im Eisbad und darauf folgender Lagerung bei 15°C für 1-2 Wochen trat Kristallisation ein. Da der Schmelzpunkt schon bei Raumtemperatur liegt, muss die Substanz kalt gelagert werden.
Ausbeute: 15,6 g (80% d.Th.)
Geruch: Süßlich-penetranter Geruch mit würzigen Nuancen.
Die Reaktionsmischung.

Filtrat nach Entfernen des Kaliumcarbonats.

DC-Analyse nach einer Std. RT und 14 h Rückflusskochen (rechts).

Restliches Et-Vanillin färbt wässrig-alkalische Phase gelb.

Trocknung der organischen Phase.

Festes O-Ethylethylvanillin.
4-Butoxy-3-methoxy-benzaldehyd (O-Butylvanillin):
In einem 50 ml Rundkolben werden 0,76 g (5,00 mmol) Vanillin und 3,50 g (25,0 mmol) Kaliumcarbonat vorgelegt und in 10 ml Acetonitril gelöst/suspendiert. Unter Rühren werden 0,92 g (5,00 mmol) 1-Butyliodid injiziert und die Reaktionsmischung 6 Stunden rückflussgekocht. Es wird filtriert, das Filtrat einrotiert und der erhaltene Rückstand mit ca. 4-5 ml Petrolether versetzt. Hierbei entstehen zwei Phasen, wobei die untere das Produkt und die obere Petrolether mit restlichem 1-Butyliodid enthält. Die untere Phase wird in Ethylacetat aufgenommen, mit Wasser und falls nötig mit NaOH 1M gewaschen, mit Natriumsulfat getrocknet und filtriert. Das Filtrat wird einrotiert und der braun-ölige Rückstand durch Kratzen mit einem Spatel und Kühlen in einem Eisbad zum Erstarren gebracht. Die Kristalle werden kurz mit wenig Petrolether/Toluol gewaschen und im Vakuum getrocknet. Da das so erhaltene Produkt immer noch seltsam roch und bräunlich gefärbt war, wurde es weiter per Säulenchromatographie aufgereingt (Eluierungsmittel: Petrolether/Ethylacetat 9:1). Dabei erhält man zuerst das gewünschte Produkt und einige Zeit später kleinere Mengen eines unbekannten Nebenprodukts. Die Produkt-Fraktionen werden einrotiert, um das reine O-Butylvanillin als farbloses Öl bzw. weiße Kristalle zu erhalten.
Ausbeute: Nur ca. 100mg, da der Großteil des Produkts schon vorher bei Umkristallisationsversuchen verbraucht wurde.
Geruch: Leider kaum wahrnehmbar...

DC-Analyse (Cyclohexan/EtOAC 3:2) nach ca. 4 Std. (rechts andere Reaktion).

Abgekühlte Reaktionsmischung.

Trocknung der organischen Phase.

Das rohe Produkt.

DC des rohen Produkts (Mitte und rechts untersch. Konz. an Produkt, links Vanillin).

Während der Säulenchromatographie.
DC-Analyse der Säulenfraktionen (Verunreinigungen ca. bei FR8-10).

Das aufgereinigte Produkt.
Entsorgung:
Die Abfälle werden in einem Behälter für organischen Müll gesammelt und einem Entsorgungsunternehmen zugeführt. Kleinere Mengen Vanillin, Aceton und Salze wie Kaliumiodid, Kaliumcarbonat können in den Ausguss gegeben werden.
Erklärung:
Die Veretherung von phenolischen Aldehyden mit einem Alkylierungsmittel und Kaliumcarbonat in Aceton ist eine bewährte Methode im Laboralltag. Obwohl in diesem Fall der niedrige Siedepunkt des Ethylbromids ein effektives Aufheizen der Reaktionsmischung auf den Siedepunkt von Aceton verhindern kann, kann durch langes Kochen eine gute Umsetzung erreicht werden. Allerdings hat sich gezeigt, dass die nötigen Rückflusszeiten für eine quantitative Umsetzung über 20 Stunden liegen könnten. Es obliegt daher der durchführenden Person, in welchem Stadium der Abbruch der Reaktion am sinnvollsten erscheint. Die Reaktion selbst ist eine SN2-Reaktion eines Phenolats- welches durch Deprotonierung eines Phenols mit Kaliumcarbonat gebildet wird- mit einem elektropositiven Alkylhalogenid. Aceton und vor allem Acetonitril sind geeignete Lösungsmittel, da sie polar- aber aprotisch sind und damit solche Reaktionen fördern. Die Reaktivität der Alkylhalogenide steigt in einer generellen Betrachtung vom Chlorid bis zum Iodid. In einer Gleichgewichtsreaktion reagieren Alkylchloride- oder Bromide mit salzartigen Iodiden zu reaktiveren Alkyliodiden (Finkelstein-Reaktion), was zur Erhöhung der Reaktionsgeschwindigkeit beiträgt.