TEMPO ist ein Radikal, das in Oxidationen als Katalysator eingesetzt wird, z.B. der Anelli-Oxidation1. Primäre Alkohole können hierbei ohne Schutzgasatmosphäre und mit nur geringer Weiteroxidation zu der entsprechenden Carbonsäure in Aldehyde überführt werden. Als Oxidantien kann eine Reihe von Verbindungen eingesetzt werden, meist Natriumhypochlorit, Ammoniumcernitrat, Trichlorisocyanursäure oder Oxone®.1 Das hier vorgestellte Triacetonammoniumsulfat ist der direkte Vorläufer des 4-Oxo-TEMPO, ein Derivat des oben genannten Radikals.
Geräte:
Rundkolben mit Schliff und Stopfen, Bechergläser, Fritte und Vakuumpumpe, Magnetrührer mit Rührfisch
Chemikalien:
Aceton
Ammoniaklösung 25%
Schwefelsäure
2-Propanol
2,2,6,6-Tetramethylpiperidin-4-onhydrogensulfat


Durchführung:
Es werden 50 mL Aceton (0,68 mol) und 25 mL (0,34 mol) 25%ige Ammoniaklösung in einen 250 mL Rundkolben gegeben. Es wird ein Spatel Ammoniumchlorid oder Calciumchlorid zugegeben, verschlossen und für 3 Monate bei Raumtemperatur unter gelegentlichem Umschwenken ruhen gelassen.
Nach dieser Zeit (in der sich die Flüssigkeit orange bzw. dunkelrot gefärbt hat) wird in einem Becherglas unter magnetischem Rühren mit kalter, konzentrierter Schwefelsäure (diese kann auch leicht verdünnt werden, ich habe meine 10 mL mit einem Eiswürfel gekühlt) versetzt, bis man in etwa pH=5 erreicht. Sofort fällt aus der orangen Lösung ein heller, leicht gelblicher Feststoff aus (Empfehlung: man fügt vor der Säurezugabe etwas Isopropanol zu, dann hat man nachher keinen Schlamm, sondern eine schöne Suspension). Wenn pH=7 erreicht ist, nimmt die Lösung eine kirschrote Farbe an. Man rührt etwa 30 Minuten weiter. Die Suspension wird mithilfe einer Fritte filtriert, einmal mit Aceton und einmal mit Isopropanol gewaschen. Man erhält einen weißen Feststoff (2,2,6,6-Tetramethylpiperidin-4-onhydrogensulfat) und ein kirschrotes Filtrat.
Ausbeute: 9,3 g (10,9% d.Th. bei M = 252 g/mol5)
Zur Katalysatorwahl: mit Ammoniumchlorid färbte sich die Mischung bei mir schnell rot, bei Calciumchlorid wurde sie gelb bis orange (Bild 3). Da der Ansatz mit Ammoniumchlorid aufgrund fehlerhafter Aufarbeitung als Schlamm endete, kann ich bezüglich der Ausbeute nichts sagen.
Entsorgung:
Das Triacetonammoniumsulfat wird zu den halogenfreien organischen Abfällen gegeben.
Das Filtrat aus dem ersten Syntheseschritt wird zu den halogenfreien organischen Abfällen gegeben.
Erklärung:
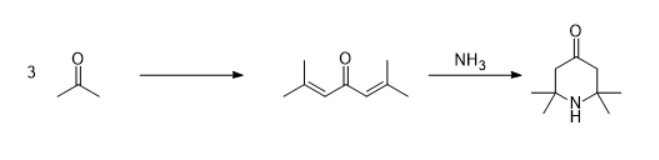
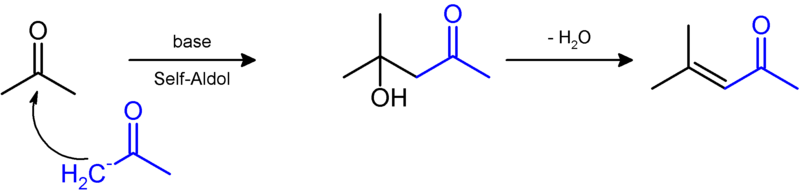
Aceton kondensiert in einer Aldol-Reaktion mit sich selbst und bildet Mesityloxid4:
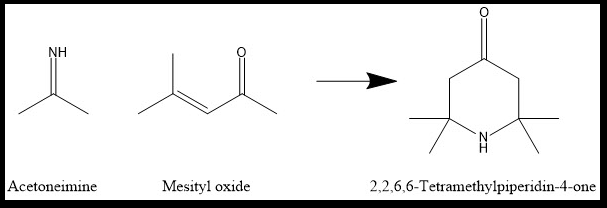
Dieses reagiert dann mit einem Molekül Acetonimin unter Cyclisierung zum 2,2,6,6-Tetramethylpiperidinon3.
Bilder:

Ansatz mit Ammoniumchlorid bzw. Calciumchlorid nach einem Tag

Ansatz mit Calciumchlorid nach einem Monat

bei der Zugabe von Schwefelsäure ausgefallener Niederschlag und kirschrote Lösung

Produkt
Quellen:
http://www.sciencemadness.org/talk/view ... #pid127902
1 Oxidation of Alcohols to Aldehydes and Ketones - A guide to current common practice, Tojo, Fernández, Springer Verlag 2006 Seite 243ff
2 http://www.sigmaaldrich.com/catalog/pro ... =de®ion=DE
3 http://www.sciencemadness.org/talk/view ... 0#pid44446
4 https://commons.wikimedia.org/wiki/File ... _oxide.png
5 https://en.wikipedia.org/wiki/Triacetone_amine