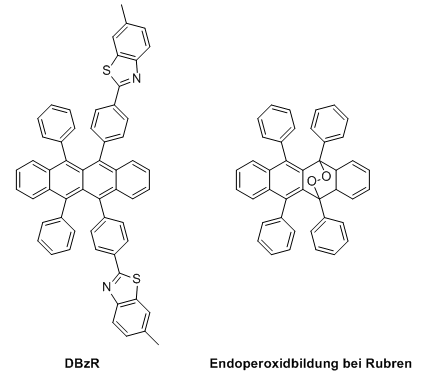
(5,6,11,12-Tetraphenylnaphthacen, Rubrene)
Rubren ist ein orangeroter bis roter polycyclischer aromatischer Kohlenwasserstoff, der als Fluorophor bei der Chemolumineszenz an Bedeutung gewonnen hat und als einer der ersten gelb leuchtenden Farbstoffe (neben 1,8-Dichlor-BPEA) in Leuchtstäben eingesetzt wurde. Wichtiger ist allerdings seine Bedeutung in Kombination mit organischen Halbleitern und der daraus resultierenden Verwendung als Dotand bei der Herstellung von organischen Leuchtdioden (OLED), bei denen sich durch die Kombination eines gelb- und eines blau-fluoreszierenden Farbstoffes ein weißes Licht erzeugen lässt. Daraufhin wurde verschiedene rubrenbasierte Farbstoffe entwickelt, die in ihren Leuchteigenschaften besser angepasst wurden, aber aufgrund der chemischen Instabilität die Lebensdauer der OLEDs verringern. Ein wichtiger Vertreter der gelb-fluoreszierenden rubrenbasierten Farbstoffe ist DBzR (Dibenzothiazolylrubrene, vgl. D-Luciferin).
Rubrenfarbstoffe sind oxidationsempfindlich und verlieren ihre Farbe durch Bildung von Endoperoxiden, die außerdem die Fluoreszenz stark beeinträchtigen oder sogar vollkommen verhindern.
Ein weiteres Problem der Rubrenfarbstoffe macht sich in der Herstellung von organischen Feldeffekt-Transistoren (OFETs) bemerkbar: Diese erreichen nur eine hohe Leistungsfähigkeit bei hochkristallinen (reinen) Rubren-Filmen, die schwer zu realisieren sind, da Rubren und verwandte Farbstoffe thermisch abhängig in zwei verschiedenen Konformationen kristallisieren, wie eine Untersuchung der Ruhr-Universität Bochum zeigte. In sehr dünnen Rubren- Filmen liegt das Molekül verdrillt vor, was typisch für die Gasphase ist; in dickeren Schichten hingegen tritt eine (fast) planare Kristallstruktur auf. Die Energiedifferenz beider Konformitäten liegt bei etwa 200 meV, wodurch die verdrillte Form durch Sublimation in die flache Form überführt werden kann.

Geräte:
Diverse (Mehrhals-)Kolben, Magnetheizrührer, (Vakuum-)Destille, Tropftrichter, Scheidetrichter, Rückflusskühler, Trockenrohr, Septum, Spritze mit langer Kanüle, Möglichkeit zur Saugfiltration, Rotationsverdampfer, Möglichkeit zum Arbeiten unter Schutzgas
Chemikalien:
Styren

Brom



Chloroform
Kaliumhydroxid

Dichlormethan

Ethanol
Bromethan


Natriumsulfat
Diethylether, wasserfrei


Magnesium-Späne

Iod
Benzophenon


Ammoniumchlorid

Petrolether bp. 40-80 °C


Toluen
Kalium-tert.-butanolat


n-Hexan



Triethylamin
Methansulfonylchlorid

Ethylacetat
Salzsäure
Methanol
DL-1,2-Dibromphenylethan

Phenylacetylen

1,1,3-Triphenylprop-2-in-1-ol

Rubren
Hinweis: Vorsicht beim Umgang mit Brom und Methansulfonylchlorid. Beim Arbeiten mit Diethylether Funkenbildung und elektrostatische Aufladung vermeiden.
Durchführung:
DL-1,2-Dibromphenylethan
70 mL Styren werden in 50 mL Chloroform vorgelegt und unter Kühlung tropfenweise mit 26 mL Brom versetzt, bis beim Eintropfen keine Entfärbung mehr stattfindet. Wenn alles Brom zugegeben ist, wird das Chloroform im Vakuum abgezogen und das verbleibende Öl bei Raumtemperatur zur Kristallisation stehen gelassen. Anschließend wird im Vakuum getrocknet.
Ausbeute: 138 g (86 % d. Th.)
Phenylacetylen
50 g 1,2-Dibromphenylethan werden mit 50 g gepulvertem Kaliumhydroxid in einem Rundkolben vermischt und mit 60 mL Ethanol versetzt. Anschließend wird eine Stunde refluxiert, die Mischung nach dem Abkühlen mit 80 mL Wasser versetzt und die organische Phase im Scheidetrichter abgetrennt. Die wässrige Phase wird mit Dichlormethan extrahiert (3 x 50 mL), die vereinigten organischen Phasen über Natriumsulfat getrocknet und filtriert, das Filtrat eingeengt und einer fraktionierten Destillation unterworfen wobei das Produkt bei 143 °C oder 40-45 °C/17 mbar aufgefangen wird.
Ausbeute: 13 g (68 % d. Th.)
1,1,3-Triphenylprop-2-in-1-ol
3,1 g Magnesiumspäne nach Grignard werden in 30 mL wasserfreiem Diethylether in einem ausgeheizten Mehrhalskolben mit Rückflusskühler und Trockenrohr vorgelegt und tropfenweise mit 9 mL Bromethan versetzt, wobei nach Zugabe von ca. 1 mL ein einzelner Iod-Kristall zum Starten der Reaktion zugefügt wird. Dann werden langsam 13 g Phenylacetylen in 15 mL Diethylether zur Reaktionsmischung gegeben und anschließend für 2 Stunden refluxiert. Nach Erkalten werden 23 g Benzophenon ind 27 mL Diethylether zugegeben und erneut für eine Stunde zum Sieden erhitzt. Nach Abkühlen der Mischung wird eine Lösung aus 42 g Ammoniumchlorid in 112 mL dest. Wasser langsam zugegeben, die organische Phase im Scheidetrichter abgetrennt und die wässrige Phase mit Diethylether extrahiert (3x50 mL). Die vereinigten organischen Phasen werden über Natriumsulfat getrocknet und der Ether im Vakuum abgezogen. Das verbleibende Öl wird mit Petrolether (bp. 40-80 °C) versetzt und im Gefrierschrank gekühlt. Die Kristallisation kann durch Animpfen, abwechselnd starkes Schütteln und Stehenlassen oder Rühren initiiert werden. Anschließend wird der farblose Feststoff abgesaugt, mit Petrolether gewaschen und im Vakuum getrocknet.
Ausbeute: 29,3 g (80,9 % d. Th.)
1,1,3-Triphenylprop-2-in-1-ol (alternativ)
1 g (1 eq.) Benzophenon wird mit 677 mg (1,1 eq.) Kalium-tert.-butanolat (KOtBu) in 0,9 mL (1,5 eq.) Phenylacetylen vorgelegt und bei 40 °C 2 Stunden gerührt. Anschließend wird in 20 mL Dichlormethan gelöst, über ein kurzes Kieselgelpad gereinigt und mit Dichlormethan eluiert. Das Lösungsmittel wird im Vakuum abgezogen und der ölige Rückstand in 5 mL einer Mischung aus Toluen/n-Hexan (1:1) unter Erhitzen gelöst und für mind. 3 Stunden im Gefrierschrank stehen gelassen. Anschließend wird die Lösung 2 Stunden bei 10 °C magnetisch gerührt um die Kristallisation zu vervollständigen (bei schlechter Rührbarkeit zusätzlich n-Hexan zugeben). Das ausgefallene Produkt wird abgesaugt mit Hexan oder Pentan gewaschen und weist auf der DC nur einen Spot auf.
Ausbeute: 1,34 g (85,8 % d.Th.)
Rubren
2,5 g 1,1,3-Triphenylprop-2-in-1-ol werden in 18 mL Toluen (abs.) gelöst und entgast. Zur vollständigen Lösung des Alkohols wird ggf. erwärmt. Die Lösung wird im Eisbad abgekühlt und mit 1,57 mL Triethylamin versetzt. Anschließend werden tropfenweise 1,06 mL Methansulfonylchlorid (MsCl) zugesetzt, die Mischung für 30 min bei RT gerührt und danach 4 Stunden bei 110 °C gehalten, wobei sich die gelbe Lösung rot färbt. Nach dem Abkühlen wird die Lösung mit 25 mL Ethylacetat verdünnt, mit 20 mL 2 N HCl ausgeschüttelt und die Säure anschließend mit frischem Ethylacetat extrahiert (3 x 20 mL). Die vereinigten organischen Phasen werden über Magnesiumsulfat getrocknet, filtriert und eingeengt, bis ein rotes Öl entsteht. Dieses wird in 13 mL Diethylether gelöst (wobei sich nach kurzer Zeit bereits Kristalle abscheiden), mit 13 mL Methanol versetzt, kurz erhitzt und anschließend in den Gefrierschrank gestellt. Die Kristalle werden filtriert, mit Methanol gewaschen und bei 130 °C bis zur Massenkonstanz getrocknet.
Ausbeute: 209 mg rotorange Kristalle (9 % d.Th)
Entsorgung:
Die Lösungsmittel werden, wenn möglich, recycelt oder den entsprechenden Lösungsmittelabfällen zugeführt. Die nicht halogenierten (Zwischen-)Produkte werden dem organischen (Feststoff-)Abfall und die halogenierten dem halogenhaltigen organischen Abfällen zugeführt.
Erklärung:
Als Edukt wird hier Styren verwendet und in den ersten beiden Stufen zum Phenylacetylen umgesetzt. Letzteres kann aber auch direkt als Edukt eingesetzt werden. Für die entscheidende Zwischenverbindung sind zwei unterschiedliche Synthesemethoden verfügbar, wobei die lösungsmittelfreie Reaktion von Phenylacetylen mit Benzophenon und KOtBu durch ihre Einfachheit besticht. Das 1,1,3-Triphenylprop-2-in-1-ol wird anschließend zum Rubren umgesetzt.
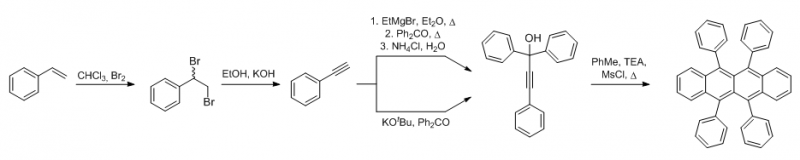
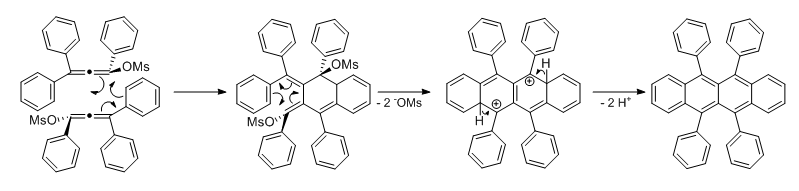
Der Interessante Schritt ist die Umsetzung zum Rubren: Das Phenylacetylen wird durch das Ethylmagnesiumbromid (oder KOtBu) deprotoniert und reagiert mit dem Keton zum Kaliumsalz des 1,1,3-Triphenylprop-2-in-1-ol welches durch saure Aufarbeitung in den freien Alkohol überführt und anschließend mit Methansulfonylchlorid verestert wird. Der Ester bildet das reaktive Allen, welches schließlich zum Rubren dimerisiert wobei die Mesylgruppe als Abgangsgruppe fungiert.

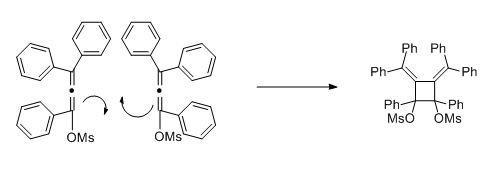
In einer Nebenreaktion - einer [2+2]-Cycloaddition - wird ein Cyclobutanderivat gebildet.
Bilder:

DL-1,2-Dibromphenylethan

Dibromphenylethan mit KOH

siedendes Reaktionsgemisch

abgesetzte ölige Phase

getrocknete Extrakte

Vakuumdestillation des Öls

fertiges Phenylacetylen

Magnesiumspäne für Grignard

nach Zugabe eines Iod-Kristalls

Zugabe des Phenylacetylens

Schlierenbildung erkennbar

vollständig deprotoniertes Phenylacetylen

Farbveränderung bei Zugabe des Benzophenons

weitere Benzophenonzugabe

Grünfärbung bei Benzophenonzugabe (mit ausgestelltem MHR)

Rotfärbung des Gemisches

intensive Rotfärbung

ausgefallenes Magnesiumalkoholat

fester Kolbeninhalt mit roter Etherphase...

... die bei längerem Stehen grün/gelblich ...

... und beim Einschalten des MHR wieder rot wird

und wieder gelb

Nach Zugabe der Ammoniumchloridlösung (untere Phase mit ausgefallenem Ammoniumchlorid durch Raumtemperatur bei 2 °C)

Extraktion der organischen Phase

Abrotieren des Lösungsmittels

auskristallisiertes Produkt

fertiges 1,1,3-Triphenylprop-2-in-1-ol (rechts nach Umkristallisieren)

vorgelegtes Benzophenon mit KOtBu (alternative Synthese)

nach der Reaktionszeit

ausgefallenes 1,1,3-Triphenylprop-2-in-1-ol (alternative Synthese)

filtriertes 1,1,3-Triphenylprop-2-in-1-ol (alternative Synthese)

vorgelegtes 1,1,3-Triphenylprop-2-in-1-ol

Farbveränderung beim Erhitzen

fortgeschrittene Reaktion

nach der Reaktionszeit

mit Ethylacetat versetzte Reaktionslösung

rotes Öl nach Abrotieren des Lösungsmittels

kristallisierendes Rubren nach Erhitzen (um Teile des Ethers zu vertreiben)

Produkt
Quellen:
- B. S. Furniss, A. J. Hannaford, P. W. G. Smith, A. R. Tatchell - Vogel’s Textbook of practical organic Chemistry 5th Edt., 1989
- M. Rajeswaran - Crystallography-Assisted OLED Materials Development, 1999
- D. Käfer, L. Ruppel et al. - The role of molecular conformations in rubrene thin film, 2005
- S. Chen, F. Yuan, H. Zhao - Efficient solvent-free synthesis of tertiary propargylic alcohols from arylacetylenes and ketones promoted by tert-BuOK, Res Chem Intermed 2013 39, pp. 2391–2399
- US Patent US 2006/0025642 A1
- Abbildung "verdrilltes Rubren": idw-online.de
Bemerkungen