(Tribrommethan)
In der folgenden Versuchsanleitung ist die die Herstellung von Bromoform beschrieben. Bromoform ist eine schwere, klare und farblose Flüssigkeit deren Geruch dem des Chloroforms ähnelt. Es ist die (laut Wikipedia) am häufigsten in der Natur auftretende organische Bromverbindung. Obwohl Bromoform wenig Verwendung im Labor findet, so ist es ein Zwischenprodukt, das bei einigen Synthesen entsteht und zu weiteren Verbindungen verarbeitet werden kann. Als Reagenz wird es beispielsweise im stark alkalischen Milieu, ähnlich wie Chloroform, deprotoniert. Durch die anschließende Abspaltung eines Bromid-Ions ist das entstandene Dibromcarben in der Lage als reaktives Zwischenprodukt (mit z.B. Olefinen) zu neuen Produkten umgesetzt zu werden. Außerdem ist es mit einer Dichte von >2 g*cm-3 als "Schwerflüssigkeit" zum Auftrennen von Mineralgemischen geeignet. In der Literatur wird dieses Verfahren jedoch selten beschrieben. Bromoform ist weiterhin ein hervorragendes Lösungsmittel für viele unpolare Stoffe. Von der Verwendung als solches ist jedoch aufgrund der nicht vernachlässigbaren Toxizität und des hohen Preises abzuraten.
Geräte:
Becherglas >1000 mL, Scheidetrichter >1000 mL, Tropftrichter 100 mL, Magnetrührer, Stativmaterial, drei Bechergläser 250 mL
Chemikalien:
Natriumhypochloritlösung, 13%ig

Aceton
Natriumbromid
Bromoform
Durchführung:
Zuerst werden in einem Becherglas 850 g Natriumhypochloritlösung vorgelegt. Anschließend werden unter Rühren etwa 155 g Natriumbromid dazugegeben. Löst sich das Salz nicht komplett, so wird mit ausreichend Wasser verdünnt. Anschließend werden etwa 36 mL Aceton tropfenweise zu der im Becherglas vorhandenen Lösung unter Rühren dazugegeben. Sobald alles Aceton zugegeben wurde, wird das Reaktionsgemisch noch für etwa fünf Minuten weiter gerührt. Danach wird der Becherglasinhalt in einen geeigneten Scheidetrichter gefüllt. Nun wartet man ausreichend lange ab, bis sich zwei klare Phasen im Scheidetrichter abgesetzt haben. Die untere Phase wird in ein Becherglas überführt, die obere Phase dagegen wird nicht über den Ablasshahn abgelassen, sondern über die Öffnung des Scheidetrichters ausgegossen und verworfen (siehe Entsorgung). Jetzt füllt man etwa 50 mL Wasser in den Scheidetrichter und gibt anschließend die aufgefangene untere Phase erneut hinzu. Jetzt wird noch einmal kräftig ausgeschüttelt. Man lässt die untere Phase wieder absetzen und achtet dabei wieder darauf, dass vor dem Abtrennen der Phasen die Flüssigkeiten komplett klar sind. Die untere Phase wird nun abgelassen und in ein geeignetes Braunglasgefäß gefüllt.
Die Ausbeute betrug bei diesem Versuch etwa 9 mL. Das sind mit der Dichte die ich ermittelt habe (2,826g/mL) 25,434g Bromoform (20,18% d. Th.).
Entsorgung:
Die wässrige Phase wird aufgehoben und nach längerem Stehenlassen (etwa eine Woche) im Ausguss entsorgt. Das Bromoform wird zu den halogenhaltigen, organischen Lösungsmittelabfällen gegeben.
Beobachtung:
Nach Zugabe des Natriumbromids zur Hypochlorit-Lösung färbt sich diese schnell gelb-orange. Nachdem man das Aceton zugegeben hat, ist eine deutliche Trübung der Lösung und die Abscheidung feiner Tröpfchen am Gefäßboden erkennbar.
Erklärung:
Die Hypochlorit-Ionen aus der Natriumhypochloritlösung reagieren mit Bromid-Ionen zu Hypobromit-Ionen sowie Chlorid-Ionen nach folgender Gleichung:
ClO- + Br- ---> BrO- + Cl-
Die nun vorhandenen Hypobromitionen stehen mit Wasser im Gleichgewicht zwischen Hypobromiger Säure und Hydroxid-Ionen nach folgender Gleichung:
BrO- + H2O ---> HBrO + OH-
Aceton bildet als typische Carbonylverbindung im alkalischen Milieu sein Enolat-Ion.
Das gebildete Enolat-Ion wird nun durch die Hypobromige Säure zu Bromaceton bromiert. Durch den elektronenziehenden Effekt des Broms ist dieses Zwischenprodukt ein stärkerer Protonendonator als die Enol-Form des Acetons. Dadurch wird das Bromaceton schnell zum Tribromaceton weiterbromiert, welches anschließend mit den Hydroxidionen aus der Lösung unter Bildung eines Acetat-Anions und des Tribrommethans reagiert.
Hinweis: Das "R" in der Abbildung stellt hier eine Methylgruppe (-CH3) im Falle des Acetons dar. Normalerweise ist "R" ein beliebiger organischer Rest.
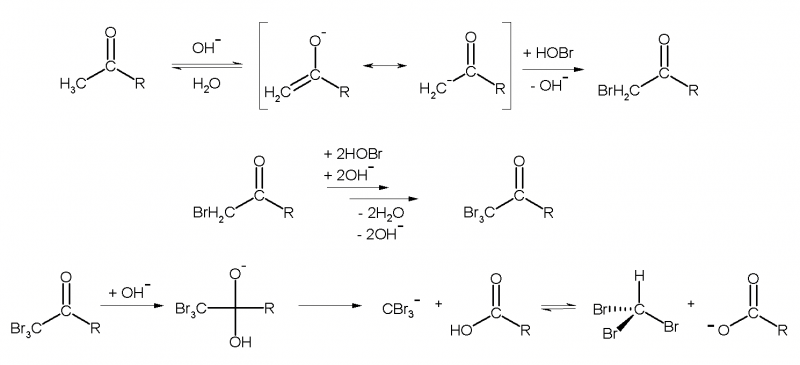
[Quelle (Abbildung Reaktionsmechanismus): Wikipedia]
Bilder:

Die Hypochloritlösung nach Zugabe des Natriumbromids

Zugabe von Aceton zu der homogenen Lösung

Bestimmung der Ausbeute (9 ml)