Acetanilid ist ein fiebersenkendes Anilinderivat, das aufgrund seiner Toxizität jedoch nicht in der Medizin verwendet wird. Stattdessen kommt häufig das strukturell ähnliche Paracetamol zum Einsatz
Geräte:
Rundkolben 250 mL, Rückflusskühler, Messzylinder 25 mL, Becherglas 750 mL, Filternutsche oder Trichter mit Filterpapier, Heizpilz
Chemikalien:
Anilin
Essigsäureanhydrid
Essigsäure 80% oder Eisessig
Zinkpulver
Eiswasser
Acetanilid
Hinweis:
Anilin ist giftig und steht im Verdacht, krebserzeugend zu sein. Im Abzug oder im Freien arbeiten.
Durchführung:
In einem 250 mL Rundkolben werden 20 ml Essigsäureanhydrid und 20 mL Essigsäure vorgelegt. Dann werden langsam 20 mL Anilin zugegeben, wobei sich das Gemisch stark erhitzt. Anschließend wird noch eine Spatelspitze Zinkpulver hinzugefügt und der Rückflusskühler aufgesetzt. Das Gemisch wird etwa 30 Minuten zum Sieden erhitzt. Nach Abschluss der Reaktion wird der Inhalt des Kolben noch heiß in 500 mL Eiswasser gegossen, wobei sofort das Acetanilid ausfällt. Der Feststoff wird abfiltriert, das Filtrat wird verworfen. Der Filterkuchen wird mit etwa 200 mL Eiswasser gespült und kann getrocknet oder aus einem Wasser-Ethanol-Gemisch (1:4) umkristallisiert werden. Man erhält weißes, relativ grobkristallines Acetanilid.
Ausbeute: 24,88 g (87,6% d. Th., bezogen auf Anilin)
Entsorgung:
Das Filtrat wird neutralisiert und zu den halogenfreien organischen Abfällen gegeben. Das Acetanilid kann weiterverwendet oder ebenfalls den organischen Abfällen zugeführt werden.
Erklärung:
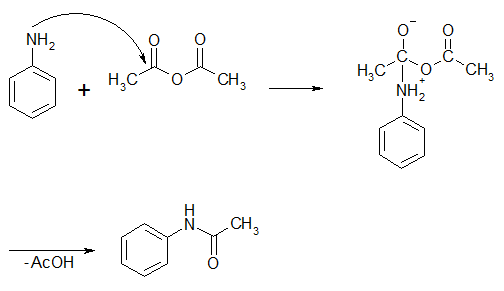
Das Anilin greift mit seinem freien Elektronenpaar nucleophil am Carbonylkohlenstoff des Essigsäureanhydrids an. Anschließend wird ein Acetation und ein Proton des Stickstoffs abgespalten, es entsteht Acetanilid.
Bilder:

Das siedende Reaktionsgemisch

Beim Eingießen in Eiswasser fallen sofort glänzende Kristalle von Acetanilid aus.

Gepresstes, noch feuchtes Produkt
