Geräte:
großes Becherglas, Spritzen
Chemikalien:
Natriumhypochloritlösung 3 %

Diese Lösung ist auch als "Eau de Labarraque" bekannt. Sie ist unter den Handelsnamen "Eau de Javel" oder "Dan Klorix" im Handel erhältlich.
Aceton
Ethanol
Natriumsulfat
Chloroform
Durchführung:
In einem Becherglas werden 200 ml Natriumhypochloritlösung vorgelegt und im Eisbad heruntergekühlt. Bei 5 °C gibt man unter magnetischem Rühren tropfenweise 8 ml Aceton so hinzu, dass die Temperatur nicht über 30 ° steigt. Nach vollständiger Zugabe des Acetons wird über Nacht im Eisbad stehen gelassen. Anschließend saugt man das Chloroform ab und trocknet es im Reagenzglas mit wasserfreiem Natriumsulfat.
Man stabilisiert mit 1 % EtOH.
Ausbeute: 4,5 g (ca. 3 ml, ca. 15 % d. Th.)
Entsorgung:
Das Chloroform wird zu den halogenhaltigen organischen Lösemittelabfällen gegeben.
Die wässrige Phase enthält Chloracetone und wird stark verdünnt in den Abfluss gegeben.
Erklärung:
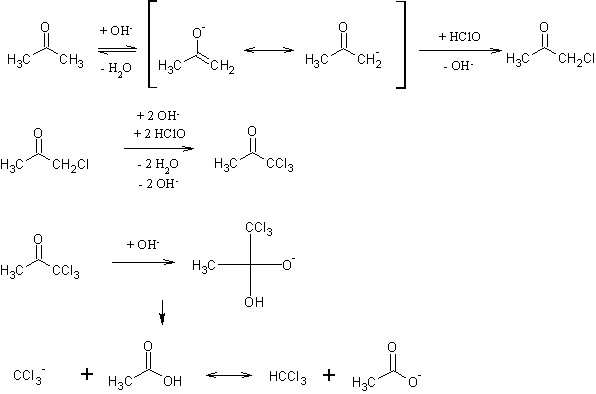
Es findet die Haloformreaktion statt:
Das Hypochlorit liegt im Gleichgewicht mit Hypochloriger Säure vor. Aus den Hypochloritanionen entstehen durch Hydrolyse Hydroxidionen und Hypochlorige Säure.
ClO- + H2O --> HClO + OH-
Das Aceton bildet unter basischen Bedingungen, ebenfalls im Gleichgewicht, sein Enolation.
Zuerst wird das Enolation durch die Hypochlorige Säure zum Chloraceton chloriert. Durch den Induktiven Effekt des Chloratoms ist dieses Zwischenprodukt acider als das Edukt, sodass zwei weitere Chlorierungsschritte zum Trichloraceton mit hoher Geschwindigkeit stattfinden. Nun wird das Trichloraceton durch ein Hydroxidion in einem Additions-/Eliminierungsmechanismus angegriffen,
wodurch ein Trichlormethan-Anion abgespalten wird, welches im wässrigen Milieu zum Chloroform protoniert wird. Daneben wird ein Acetation gebildet.
Bilder:

Das abgesetzte Chloroform (rot markiert)

Abgefülltes Trichlormethan
